Histological staining are divided into three categories:
- Bichrome methods
- Trichrome methods
- Selective methods
Bichrome methods
These techniques are easy to employ, and they are commonly used for a quick diagnose of the tissue. They provide a specific, neat result about the topography, the preservation and the general conditions of the specimen. This type of stainings draws on the general principle of the affinity of dyes for a given tissue or its pH value. The basic ones (hemalum, basic fuchsin, carmalum) stain the acidic structures found either in cells (e.g. nucleus, ribosomes) and in tissues (e.g. cartilage and acidic secretion). The acidic dyes (eosin, picric acid) stain either cellular (e.g. cytoplasm) and tissue basic components (bone and connective tissue). These dyes are used in the operating room because, thanks to the cryostat, it is possible to get an accurate histological diagnosis from a biopsy in a few minutes.
When using these techniques, sections must be cut 3-5 µm thick with the microtome, so that it is possible to stain every single cellular layer and to avoid overlaps.
Hemalum-Eosin (Em-Eo)
This is certainly the most used staining in histopathology laboratories. The nucleus and the acidic components of the cytoplasm are stained blue purple by the hemalum, a basic dye with many variants (e.g. Mayer’s, Carazzi’s, etc.). The cytoplasm and the basic components are stained pink, with variable intensity, by a mixture of eosin and slightly acidified (with acetic acid) Orange G.
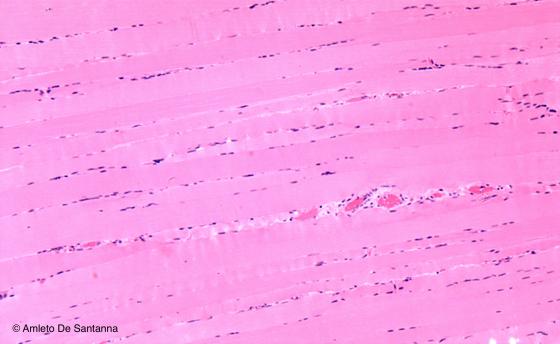
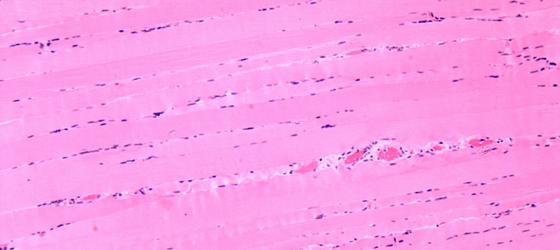
Figure S1. Human skeletal muscle. In this sample staining, the 1% eosin solution was added with a part (25%) of a 0.5% orange G solution. This addition allows to greatly differentiate the basic structures. Nuclei are stained purple with Mayer’s hemalum, the muscle fibers deep pink and the scarce connective tissue between the fibers light pink with eosin/orange G mixture. The erythrocytes in the blood capillaries are stained deep pink. H&E X63
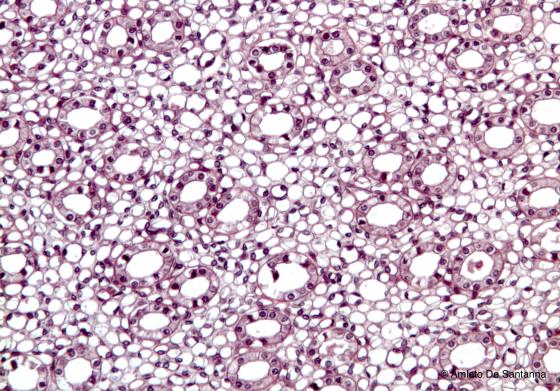
Figure S2. Rabbit kidney. The nuclei of the epithelial cells that cover the kidney tubules are stained deep purple with Mayer’s hemalum, whereas their cytoplasm is stained pink of variable intensity with the eosin/orange G mixture. H&E X100
Iron hematoxylin (Heidenain’s Hematoxylin)
It stains the acidic structures and the cellular borders intense black. Its affinity with some components present in the tissues brings out the cellular borders and the transverse striations across muscle fibers more clearly. It can be contrasted with eosin or other acidic dyes.
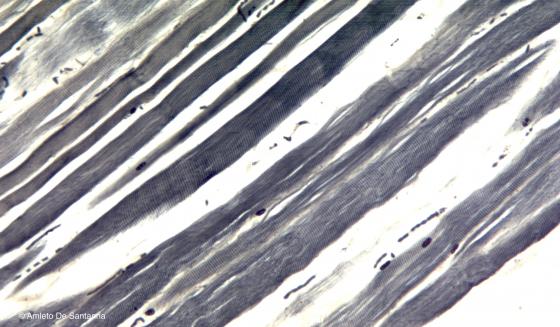
Figure S3. Dissociated human muscle fibers stained with iron hematoxylin. This staining method highlights also, in addition to basophilic structures like nuclei, the cellular borders and the transverse bands of the striated muscle fibers. Iron hematoxylin X100

Figure S4. High magnification of human striated muscle fibers stained with iron hematoxylin. With this staining method, the transverse bands of the skeletal muscle fibers appear alternatively black or colorless. Iron hematoxylin X400
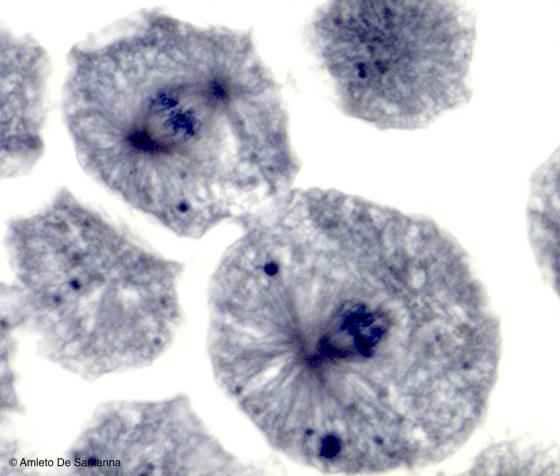
Figure S5. Human cells in mitosis. You can easily see the mitotic spindle and the chromosomes aligned along the equatorial plane. Iron hematoxylin X1000
Colorazioni tricromiche
Molte di queste colorazioni derivano dal metodo originale di Mallory. Le varianti più comunemente usate sono quelle di Masson, di Galgano e di Heidenhain. Queste colorazioni hanno la particolarità di affiancare ad un colorante basico due o più coloranti acidi che, grazie all’intervento di acidi deboli detti mordenzanti (acido fosfowolframico o fosfomolibdico), differenziano in modo più preciso le varie componenti tissutali. In istologia il termine mordenzante indica composti chimici che oltre a fungere da catalizzatori inibiscono o accrescono le affinità di alcuni coloranti verso determinati componenti tissutali. Le colorazioni tricromiche sono generalmente molto brillanti ma di difficile esecuzione, per cui, ormai, vengono usate quasi esclusivamente a scopo didattico.
Tricromica di Heidenhain (Azan-Mallory)
Questa colorazione deriva dal metodo di Mallory. Come le altre colorazioni tricromiche si basa, oltre che sulle proprietà acido-basiche dei tessuti, anche sulla diversa affinità dei vari coloranti acidi usati. Nella variante di Heidenhain, l’azocarminio colora le strutture acide di rosso-porpora molto acceso, mentre le strutture basiche (fibre collagene, tessuto osseo, muco) reagiscono con il blu di anilina o il violetto arancio (tessuto muscolare) dell’orange G. Il citoplasma, in generale, sarà arancione pallido. Con questa colorazione otteniamo una netta separazione tintoriale tra il tessuto muscolare e quello connettivo. Si noti che questa metodica è incompatibile con alcuni fissativi (es. formalina) e, normalmente, è preferibile usare fissativi a base di sublimato corrosivo, come il Susa o lo Zenker.
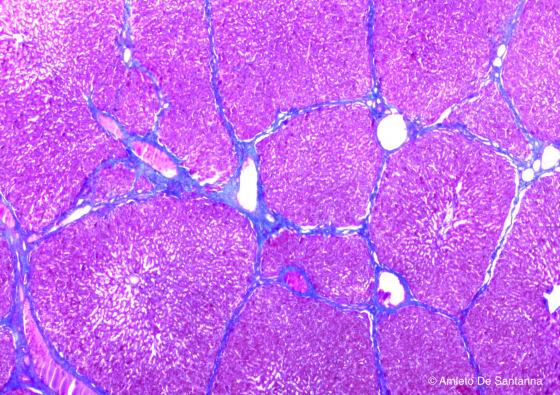
Figura S6. Fegato di maiale. Il citoplasma degli epatociti è colorato in rosa tenue dall'orange G, i sepimenti connettivali in blu intenso dalla miscela di Mallory. Mallory-Azan 25x
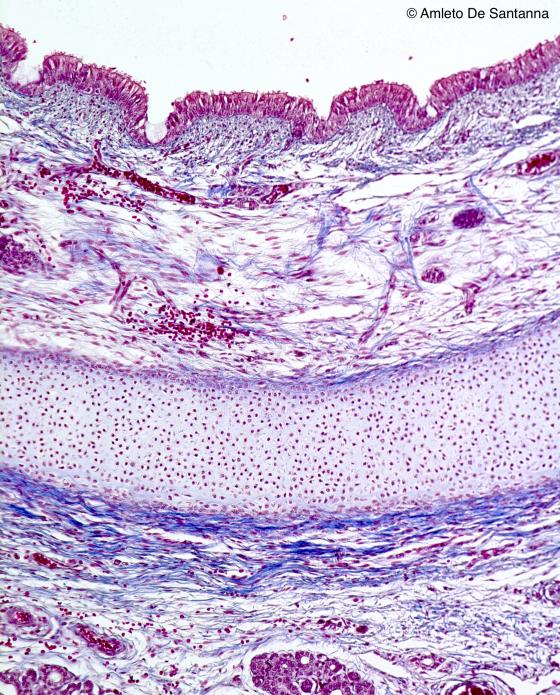
Figura S7. Trachea di feto umano. I nuclei delle cellule, le ghiandole sierose e gli eritrociti sono colorati in rosso con intensità variabile dall’Azocarminio G, il connettivo è colorato in blu dal Blu di Anilina, le fibrocellule muscolari in violetto e il citoplasma delle cellule in rosa dall’Orange G. Mallory-Azan 25x
Tricromica di Mallory secondo Galgano
Con questa metodica il colorante basico, l’emallume di Mayer, colora le strutture acide in violetto intenso, mentre i coloranti acidi sono blu di anilina e orange G. Questa colorazione viene usata quando i pezzi sono fissati in formalina e perciò incompatibili con la tricromica di Heidenhain.
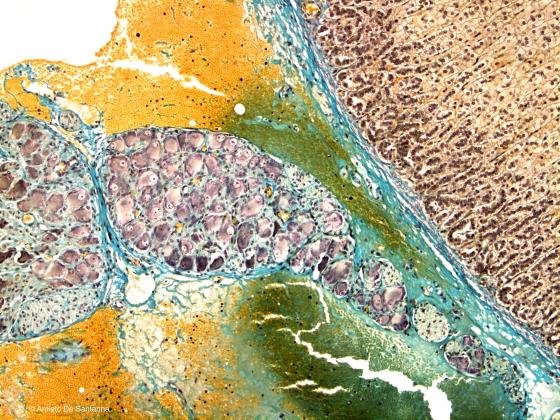
Figura S8. Ganglio parasimpatico presente nella capsula surrenale di coniglio. In questa colorazione l’emallume di Mayer (viola) è stato sostituito dall’Ematossilina Ferrica (nera). I nuclei delle cellule sono colorati in nero, il citoplasma in grigio, il connettivo in blu intenso e gli eritrociti in giallo-verde. Galgano mod. 100x
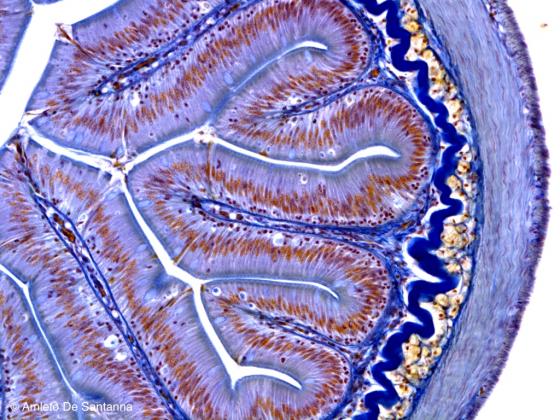
Figura S9. Intestino tenue di pesce. I nuclei sono colorati in viola, il connettivo in blu, il secreto intracitoplasmatico di alcune cellule epiteliali in giallo-ocra. Mallory mod 200x
Tricromica di Masson
È particolarmente indicata per riconoscere i vari tipi di cellule del connettivo. Colora i nuclei in viola con l’ematossilina; il citoplasma in rosso più o meno vivo con la fucsina acida, il connettivo e le strutture fortemente basiche in blu con il blu di anilina. E’ specifica per i diversi tipi cellulari dell’adenoipofisi.
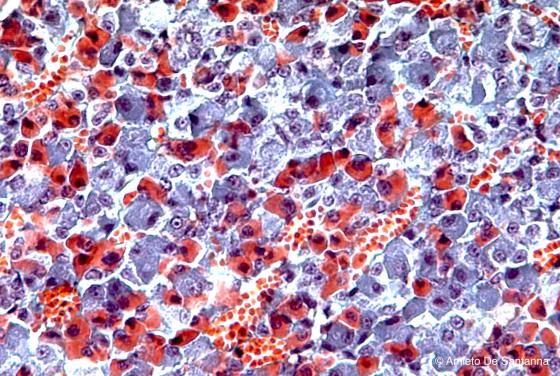
Figura S10. Adenoipofisi umana. Sono visibili, colorati in rosso arancio, gli eritrociti (contenuti nei vasi) e le cellule con citoplasma basico; i nuclei e le cellule con citoplasma acido sono colorate in viola, le cellule cromofobe risultano colorate tenuamente. Tricromica di Masson 200x
Ignesti
È una tricromica con colori particolarmente brillanti. Viene usata l’affinità dell’Aurantia, colorante acido, per il tessuto muscolare. Avremo così nuclei colorati in viola intenso da una qualsiasi emallume, il connettivo in azzurro per l’azione della miscela di Mallory e il muscolare in giallo ocra. E’ una colorazione, anche se di difficile esecuzione, usata in istopatologia per mettere in evidenza particolari patologie delle fibre muscolari.
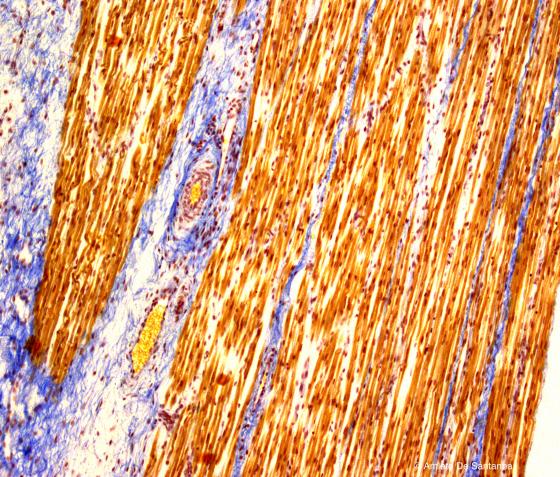
Figura S11. Lingua umana. Si nota, in maniera evidente, la differenza di colorazione fra le fibre connettivali, colorate in blu dal Blu di Anilina, le fibrocellule muscolari in giallo ocra dall’Aurantia. Come colorante nucleare è stato usato l’Emallume di Mayer. Ignesti 100x
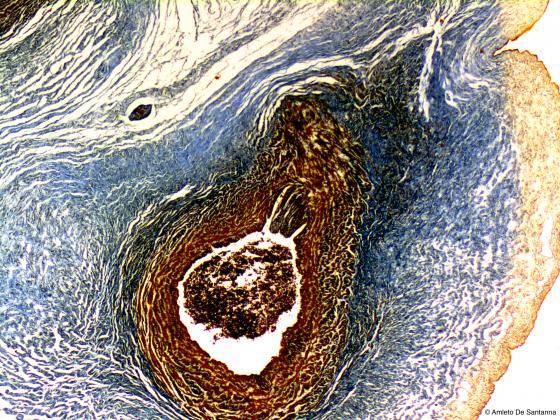
Figura S12. Funicolo ombelicale umano. Il tessuto connettivo è colorato in blu e il tessuto muscolare, che circonda un grosso vaso sanguigno, in giallo ocra. I nuclei sono colorati in viola. Ignesti 25X
Colorazioni istologiche elettive
Quando si vuole mettere in evidenza una componente tissutale particolare (ad es. le fibre reticolari o elastiche) o esaltarne un’altra che, per le sue caratteristiche chimiche o strutturali risulta di difficile evidenziazione (ad es. le fibre nervose), si usano metodi e coloranti specifici: queste colorazioni vengono dette elettive. Queste sono colorazioni che colorano elettivamente un tessuto o un suo determinato componente, molte volte a scapito di una chiara visione topografica del preparato.
Colorazioni elettive per il tessuto connettivo
In queste colorazioni le sezioni devono essere tagliate al microtomo con uno spessore di circa 10-12 µm in modo da poter seguire il decorso delle fibre colorate per tratti il più possibile ampi.
Bielschowsky-Maresch
É il metodo originale per la colorazione delle fibre reticolari altamente affini all’argento metallico, tanto che possono essere definite anche fibre argirofile. Siccome è di difficile esecuzione prevede molte varianti dal Gomori, all’ Achuarro-Del Rio Ortega, al Tibor-Papp. Di fondo c’è una fissazione prolungata in formalina, da dieci giorni a due-tre mesi, l’uso di una soluzione ammoniacale d’argento che, depositandosi elettivamente sulle fibre reticolari e, successivamente ridotto ad argento metallico, assume la caratteristica colorazione nera intensa del metodo. Tutta la reazione deve avvenire in presenza di luce solare, che funziona da catalizzatore e di quantità stechiometricamente esatte di ammoniaca, altrimenti le fibre non si colorano o si colorano troppo.
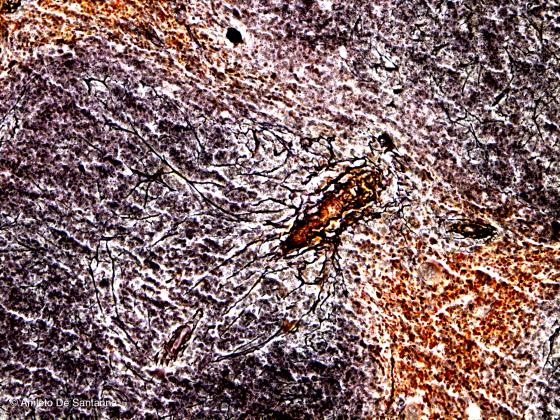
Figura S13. Milza di topo. Questa colorazione elettiva mette in evidenza le fibre argirofile reticolari colorandole in nero intenso. La sezione di tessuto deve essere sufficientemente spessa (12-14 micron) da mettere in evidenza il decorso delle fibre connettivali. Bielschowski Maresch 200x
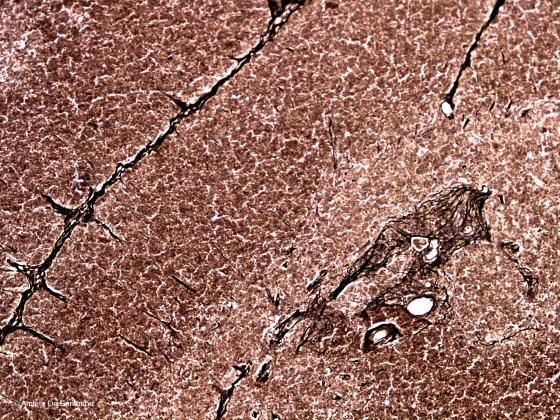
Figura S14. Timo di topo. Questa colorazione mette in evidenza la sottile trama reticolare della midollare del timo. Bielschowski Maresch 100x
Resorcin-fucsina di Weigert
È una colorazione specifica per le fibre elastiche che vengono colorate selettivamente in nero-viola su un fondo praticamente incolore. Si può fare un contrasto colorando i nuclei con emallume.
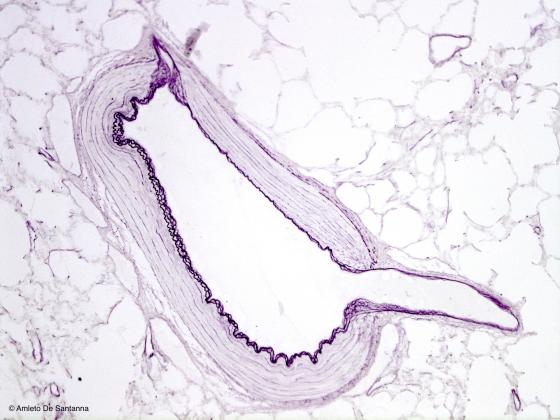
Figura S15. Polmone di coniglio. In viola-nero sono evidenziate le fibre elastiche nella parete di una grossa arteria. Si noti il classico andamento sinuosidale delle fibre elastiche. Weigert per le fibre elastiche. 100x.
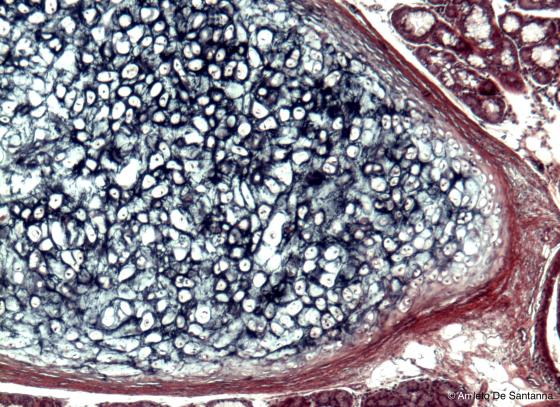
Figura S16. Cartilagine elastica umana. Weigert per le fibre elastiche 100x.
Sudan III e Sudan Black
Queste colorazioni servono per evidenziare elettivamente le goccioline lipidiche contenute nelle cellule adipose. Le sezioni si ottengono da pezzi congelati e tagliati al criostato in modo da evitare i successivi passaggi nei solventi organici necessari per l’inclusione in paraffina che scioglierebbero irrimediabilmente le goccioline lipidiche. Il Sudan III colora le goccioline lipidiche in giallo-arancio mentre il Sudan Black le colora in nero. Qualora si debba fissare il tessuto è preferibile usare una miscela a base di sublimato corrosivo o il formolo-calcio perchè, fissando in tempi molto brevi, si previene lo scioglimento dei lipidi.

Figura S17. Mesentere di topo. Sezione ottenuta al criostato a -40°C per evitare i passaggi in solventi organici che avrebbero estratto i lipidi presenti. Questa colorazione elettiva evidenzia con un precipitato nero la gocciolina lipidica contenuta nella cellula adiposa. Sudan Black 63x
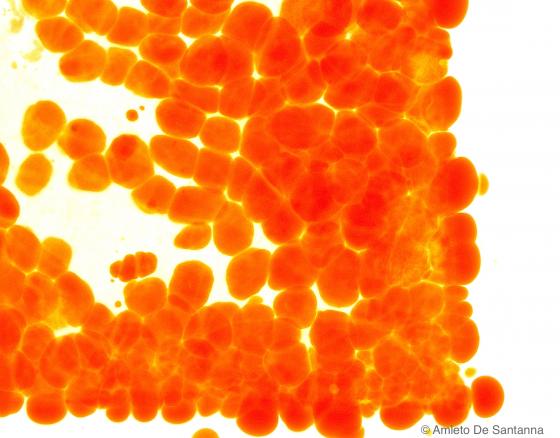
Figura S18. Mesentere di topo. Colorazione elettiva per il tessuto adiposo su sezioni ottenute al criostato. Sudan III 63x
Colorazioni elettive per il tessuto osseo
Questo tessuto,a causa della sua durezza, crea molti problemi tecnici, sia nell’inclusione che, soprattutto, nel taglio. Per questo motivo, quando la metodica non lo sconsigli, si tende a decalcificare i pezzi in modo da eliminarne la parte inorganica. I liquidi decalcificanti (EDTA, acido nitrico, acido cloridrico) sono molto invasivi e a volte, se non usati con estrema cura, rovinano irrimediabilmente il tessuto da analizzare. Quando l’analisi del tessuto non permette la decalcificazione, si possono ottenere dei buoni preparati con frammenti di tessuto osseo abrasi e ridotti allo spessore di poche decine di µm che, successivamente posti con una goccia di balsamo fra due vetrini, danno una chiara visione dell’organizzazione del tessuto osseo in osteoni.
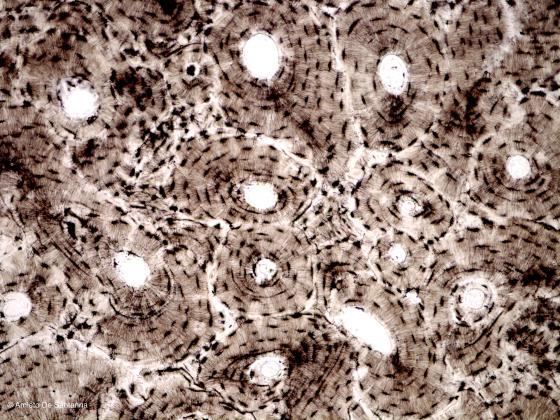
Figura S19. Sezione trasversale di tessuto osseo ottenuta per abrasione, senza nessun trattamento chimico e non colorato. Il frammento di tessuto osseo è stato compresso fra due vetrini con una goccia di balsamo del Canada. 63x
Von Kossa
In questa colorazione si evidenziano i sali di carbonato e fosfato di calcio in nero intenso con argento metallico. Per avere una migliore visione topografica è utile contrastare con una colorazione di fondo (Em-Eo, Azan, ecc.).
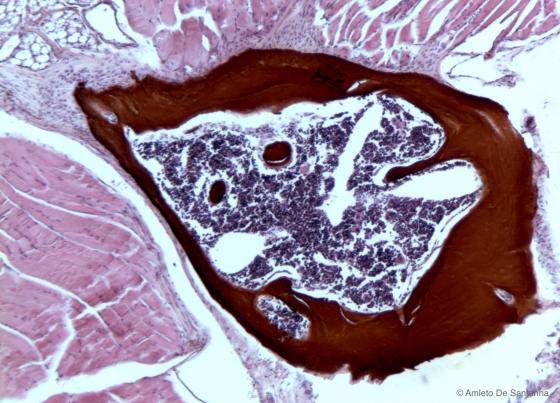
Figura S20. Vertebra di topo tagliata trasversalmente, non decalcificata e colorata in modo specifico per il tessuto osseo, che è evidenziato da un precipitato marrone scuro. Von Kossa-Em-Eo 63x
Colorazioni elettive per il tessuto nervoso
Le caratteristiche del tessuto nervoso associate alla sua delicatezza fanno sì che sia estremamente difficile ottenere preparati di buona qualità e durevoli nel tempo. Si possono ottenere preparati da pezzi colorati in toto e poi inclusi in paraffina e tagliati, oppure ottenuti dopo colorazione per schiacciamento fra due vetrini o, infine, con metodi tradizionali. Molto dipende dall’esperienza, dalla qualità dei prelievi e dalla risoluzione di una serie di problematiche che possono emergere durante l’allestimento del preparato.
Nissle
È una colorazione per il sistema nervoso centrale e si usa su sezioni in paraffina di 10 µm di spessore. E’ relativamente semplice, mette in evidenza la zona tigroide del Nissle, caratteristica del citoplasma dei neuroni, colorandola con il blu-azzurro tipico del blu di toluidina. Vengono colorati in azzurro tenue anche i sepimenti connettivali.
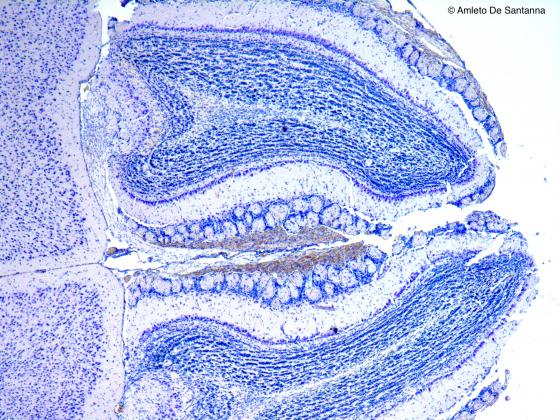
Figura S21. Encefalo di topo. Sezione longitudinale colorata con il Blu di toluidina specifico per le cellule nervose.Nissle 25x
Golgi (secondo Cajal)
Piccoli pezzi molto freschi di sistema nervoso centrale vengono trattati da 1 a 5-6 giorni (a seconda dell’animale, delle dimensioni del pezzo e delle sue caratteristiche) in soluzione osmio-bicromica, in termostato a 25°C. Quando è possibile, è indicata una pre-fissazione con paraformaldeide al 2% per perfusione, per prevenire del tutto fenomeni di necrosi cellulare. Il pezzo viene poi colorato con nitrato d’argento all’1% in acqua. La reazione, a seconda delle caratteristiche e delle dimensioni del pezzo, può durare fino a 3 giorni. A colorazione avvenuta si includono i pezzi in paraffina e si tagliano, al microtomo a slitta, sezioni molto spesse, intorno a 40-50 µm, per avere una visione il più completa possibile del tessuto e dei vari costituenti cellulari. Si ha una buona colorazione quando le cellule nervose spiccano in nero intenso su un fondo color tabacco. Essendo di difficile e incostante riuscita sono state proposte, da vari autori, diverse varianti (Golgi-Bubenaite, Golgi-Cox, ecc.) ma le difficoltà di riuscita sono pressochè identiche.
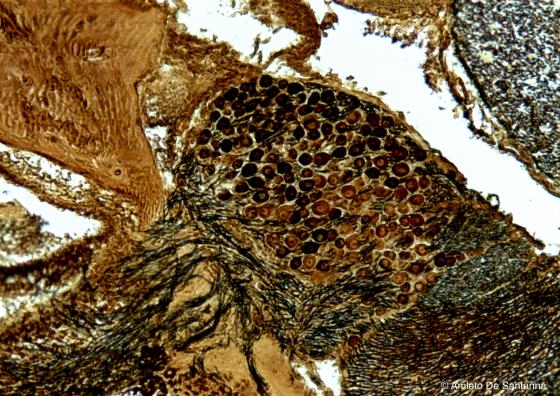
Figura S22. Embrione umano. Ganglio spinale in situ con colorazione elettiva per le cellule del sistema nervoso centrale. Golgi-Cox 100x
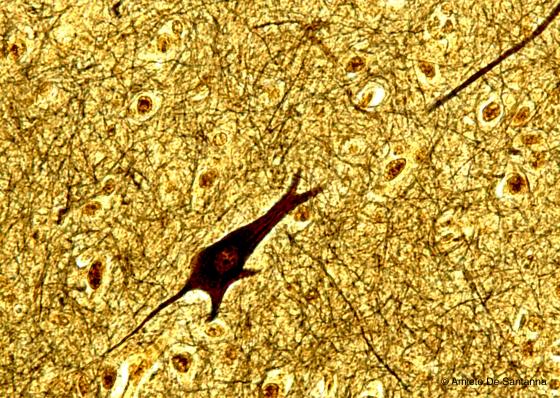
Figura S23. Tenecefalo umano. Neurone multipolare colorato secondo il metodo di Cajal. Cajal 200x
Bielchowsky
Anche questo è un metodo complicato e di difficile riuscita, molto usato per il sistema nervoso periferico. Si basa sull’affinità che l’argento ammoniacale ha per le fibre nervose quando viene ridotto dalla formaldeide ad argento metallico. Fattori variabili come la fissazione, il pH e la temperatura possono influenzare l’intensità e la precisione di questa impregnazione. A colorazione avvenuta si vedranno le fibre nervose colorate in nero su un fondo grigio più o meno intenso. Per consentire di seguire adeguatamente l’andamento non rettilineo delle fibre le sezioni devono essere spesse almeno 12-14 µm. Con questo metodo si colorano anche le terminazioni nervose.
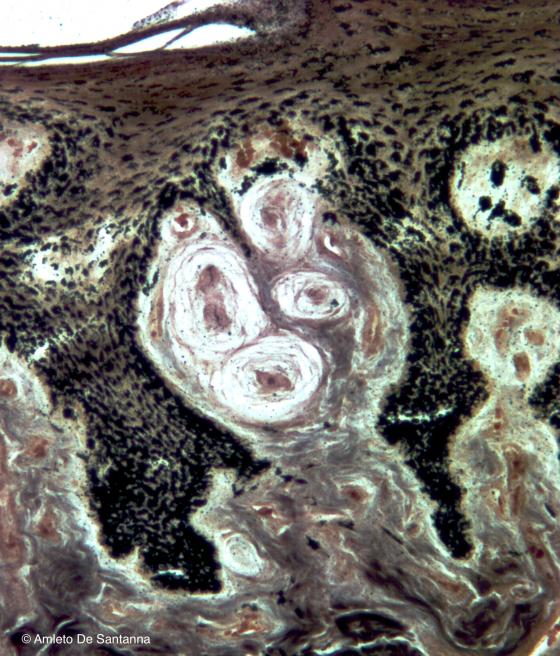
Figura S24. Cute di balena. Nel sottocutaneo, in una papilla dermica che si incunea fra le creste epiteliali, si nota un gruppo di terminazioni nervose (Corpuscoli di Pacini) che presentano una terminazione nervosa libera centrale colorata in nero intenso (frecce) circondate da lamelle concentriche connettivali atte ad amplificare lo stimolo tattile. Bielschowsky 100x
Ruffini
Colorazione in toto di pezzi, anche voluminosi, adatta soprattutto alla ricerca di terminazioni nervose e di grosse fibre periferiche. Riesce su tessuto fresco a cui non siano stati fatti trattamenti preventivi, neanche un lavaggio in acqua distillata. Dopo la colorazione con cloruro d’oro, i pezzi ottenuti si macerano in glicerina per almeno sei mesi prima di prelevare piccoli frammenti e, per delacerazione, ottenere preparati da osservare al microscopio ottico. Sei mesi rappresentano il tempo minimo di macerazione e si ottengono ottimi preparati anche dopo molti anni. A colorazione terminata si osserveranno le terminazioni e il tessuto nervoso in generale colorati in nero intenso su un fondo violetto.
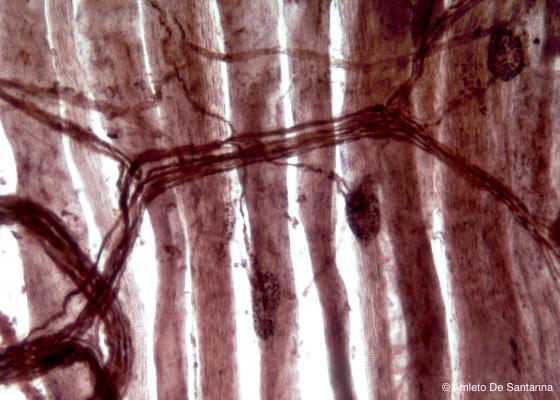
Figura S25. Placche motrici di muscolo striato di rana. Le fibre nervose e le placche motrici sono colorate in viola intenso. Ruffini 100x
Colorazioni elettive per il sangue
Gli strisci di sangue si ottengono per strisciamento di una goccia di sangue fresco tra due vetrini coprioggetto, uno posto a 45° rispetto all’altro. Si lascia essiccare per alcuni minuti e, dopo una rapida fissazione in citofix o altro blando fissativo, si colorano con eosina-ematossilina oppure con il metodo di Pappenheim.
Colorazione per perfusione
Si inietta in un grosso vaso dell’animale una soluzione molto diluita di colorante vitale (di solito si usano Blu di metile o Rosso vitale diluiti 1:10000 o 1:15000). Il colorante vitale isotonico a 37°C viene iniettato per circa 5-10 min, ad intervalli di tempo costanti. Si preleva l’organo prescelto, si lascia all’aria per 10 min e poi si fissa in molibdato ammonico al 10%. Infine si disidrata velocemente e si include in paraffina molto morbida.
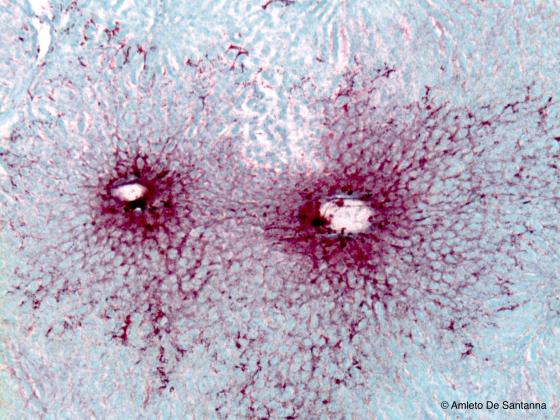
Figura S26. Fegato di topo dopo iniezione intravenosa di colorante vitale. Si noti la sottile trama dei capillari sinusoidi(colorati in rosso) che confluiscono nelle vene centrolobulari. Iniezione vitale 63x