Si definisce tessuto connettivo specializzato un tipo di tessuto connettivo che per le sue peculiari funzioni assume caratteristiche istologiche tali da distinguerlo chiaramente dagli altri tessuti connettivi.
I tessuti connettivi altamente specializzati sono:
- tessuto adiposo
- tessuto cartilagineo
- tessuto osseo
- tessuto linfoide
- sangue
Nota: il tessuto cartilagineo ed il tessuto osseo vengono comunemente definiti tessuti connettivi di sostegno.
Tessuto adiposo
Il tessuto adiposo è formato da cellule chiamate adipociti, che hanno la funzione di accumulare grassi in vacuoli citoplasmatici.
Esistono due tipi di tessuto adiposo il tessuto adiposo bianco (o uniloculare) e il tessuto adiposo bruno (o multiloculare)
Tessuto adiposo bianco
Gli adipociti che formano il tessuto adiposo bianco presentano all’interno del citoplasma un’unica grande goccia di materiale lipidico (da qui il termine tessuto adiposo uniloculare) che sposta il nucleo, appiattendolo, in posizione eccentrica. Non essendo circondata da membrana, la goccia lipidica di fatto rappresenta un’inclusione cellulare. Oltre alla funzione di riserva energetica il tessuto adiposo bianco presenta funzione di isolamento termico, di riempitivo e di protezione di alcune strutture anatomiche come nelle cavità orbitarie e nelle logge renali.
Tessuto adiposo bruno
Gli adipociti che formano il tessuto adiposo bruno presentano all’interno del citoplasma numerose gocce di materiale lipidico (da qui il termine tessuto adiposo multiloculare), il nucleo risulta in posizione centrale, rotondo, il citoplasma appare ben evidente. La funzione del grasso bruno è quella di immagazzinare riserve che sono però poi dissipate prevalentemente in energia termica. Il tessuto adiposo bruno è ben rappresentato negli animali che vanno in letargo. Nella specie umana lo troviamo ben rappresentato nel neonato, dove svolge funzione di protezione dalla basse temperature, mentre nell’adulto è scarsamente rappresentato: è presente solamente nell’ilo del surrene e nelle regioni sottoscapolare, ascellare e pubica.
Entrambi i tipi di tessuto derivano da una cellula progenitrice comune, il preadipocita, che può differenziare sia in grasso bianco che in grasso bruno.
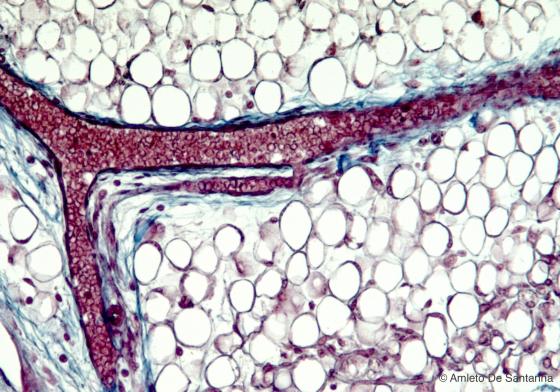
Figura C44. Mandibola di feto umano a termine. Tessuto adiposo uniloculare. La cellula adiposa è occupata quasi esclusivamente da una grossa gocciolina lipidica, il citoplasma è rappresentato da un sottile anello che circonda la gocciolina, il nucleo è allungato, piccolo e schiacciato in periferia. La gocciolina lipidica è stata estratta durante la processazione del preparato da alcool e solventi organici, per cui nell'adipocita è rimasta solo l'impronta incolore della gocciolina lipidica. Azan-Mallory 160x
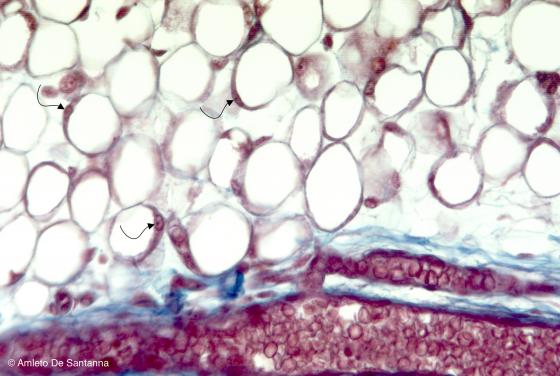
Figura C45. Mandibola di feto umano a termine. Tessuto adiposo uniloculare a più forte ingrandimento. Si notano i nuclei delle cellule adipose (frecce). Azan-Mallory 200x
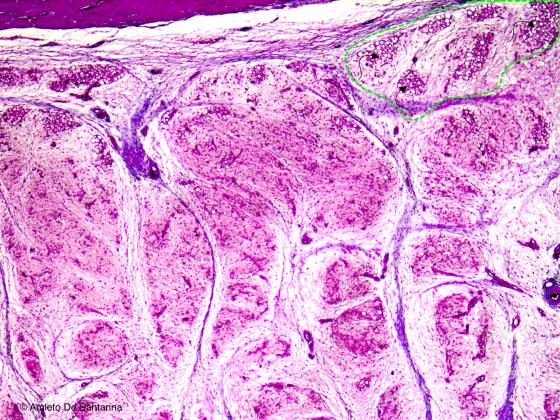
Figura C46. Piede fetale umano. Il tessuto adiposo multiloculare appare, sin dalla vita fetale, frammisto a quello uniloculare (frecce all’interno dell’area tratteggiata) e solo in alcune zone specifiche del corpo umano, senza più svilupparsi in altre regioni del corpo durante la vita. Con l’età adulta tende a trasformarsi in grasso uniloculare. In condizioni di digiuno prolungato o di esposizione al freddo intenso questo tipo di tessuto adiposo può aumentare la sua massa e la sua consistenza. Azan-Mallory 40x
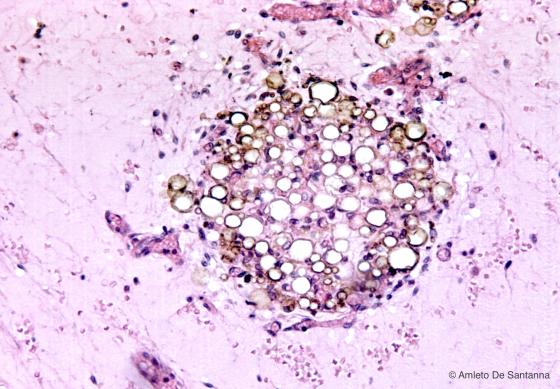
Figura C47. Tessuto adiposo nel mesentere di marmotta. Si nota del grasso bianco o uniloculare con inframezzate numerose cellule di grasso bruno o multiloculare. Em-Eo 64x

Figura C48. Tessuto adiposo di marmotta. Si nota del grasso uniloculare bianco, riconoscibile per lo scarso citoplasma e il nucleo fortemente schiacciato in periferia, con inframezzate, cellule adipose dal nucleo rotondo e centrale e citoplasma più evidente e ben distribuito all'interno della cellula in cui sono presenti tante piccole goccioline lipidiche. Queste cellule formano il tessuto adiposo multiloculare o grasso bruno. Nei mammiferi, questo tessuto è generalmente presente nei feti, nei primi mesi di vita e in quegli animali che vanno in letargo e che devono, quindi, avere una buona riserva di calore per periodi molto lunghi. Negli altri mammiferi adulti il grasso bruno è poco rappresentato. Em-Eo 200x
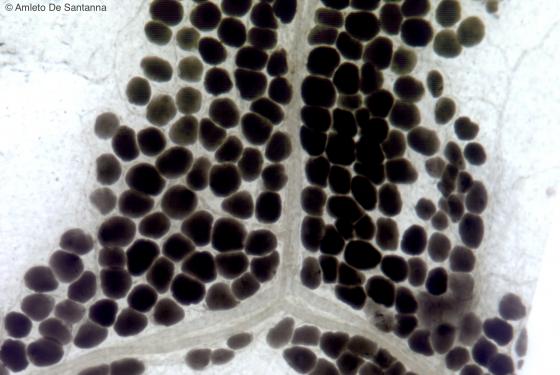
Figura C49. Omento umano. Tessuto adiposo uniloculare che circonda un piccolo vaso. Questo preparato è stato ottenuto per congelamento e tagliato al criostato a -40°C per evitare i passaggi con solventi, come xilolo o benzolo, che avrebbero sciolto la gocciolina lipidica. Successivamente la fettina è stata colorata con il metodo al tetrossido d'osmio. Osmio 64x

Figura C50. Omento umano. Tessuto adiposo uniloculare che circonda un piccolo vaso. Questo preparato è stato ottenuto per congelamento e tagliato al criostato a -40°C per evitare i passaggi con solventi, come xilolo o benzolo, che avrebbero sciolto la gocciolina lipidica. Successivamente la fettina è stata colorata con il metodo del Sudan Black, che è una colorazione elettiva per il tessuto adiposo. Sudan Black 100x
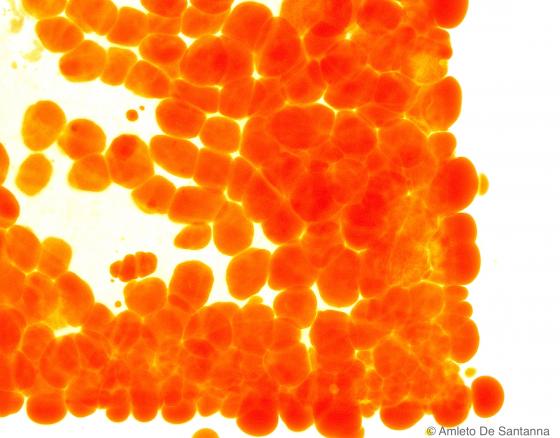
Figura C51. Mesentere di topo. Colorazione elettiva per il tessuto adiposo su sezioni ottenute al criostato. Sudan IV 63x
Tessuto cartilagineo
Il tessuto cartilagineo è un tessuto connettivo specializzato, costituito da cellule, i condroblasti e i condrociti, circondate da una matrice extracellulare allo stato di gel con fibre. La cartilagine è l’unico tessuto connettivo sprovvisto di vasi sanguigni, per cui il nutrimento di questo tessuto è affidato alla permeabilità della matrice extracellulare. La cartilagine è generalmente rivestita da un connettivo capsulare, il pericondrio, fatta eccezione per le articolazioni dove non presenta pericondrio ed è a diretto contatto con il liquido sinoviale. I condroblasti sono ospitati in lacune della matrice extracellulare dove possono dividersi a formare dei piccoli gruppi cellulari chiamati gruppi cellulari isogeni (o più semplicemente gruppi isogeni), circondati da matrice extracellulare.
La cartilagine, a seconda delle caratteristiche della matrice extracellulare e quindi della sua funzione, si divide nelle seguenti tre tipologie principali:
- cartilagine ialina
- cartilagine fibrosa
- cartilagine elastica
Cartilagine ialina
È sicuramente il tipo di cartilagine più rappresentato nei mammiferi. I condrociti presentano un nucleo ben evidente con uno o più nucleoli e sono alloggiati in lacune o depressioni della matrice extracellulare. Quando la cartilagine ialina è matura, i condrociti tendono a raggrupparsi in isolotti, i gruppi isogeni. Questi sono più numerosi nella zona profonda della cartilagine e più scarsi nelle zone più periferiche (zona intermedia e zona tangenziale). I gruppi isogeni sono generalmente assenti nella cartilagine ialina immatura. La cartilagine ialina è avascolare e generalmente circondata da pericondrio. La matrice, povera di fibre, è formata prevalentemente da sostanza amorfa ricca di proteoglicani. La maggiore concentrazione di proteoglicani si trova nella matrice che circonda i gruppi isogeni (matrice extracellulare territoriale), mentre la restante parte di matrice extracellulare è caratterizzata da una minor presenza di proteoglicani (matrice extracellulare interterritoriale).
La cartilagine, a seconda della quantità dei suoi componenti acidi (sialomucine, ialomucine), è più o meno basofila, per cui dal punto di vista dell’affinità tintoriale è facilmente riconoscibile dagli altri tessuti connettivi, sempre acidofili.
La cartilagine ialina ha, oltre che una funzione di sostegno, il compito di dare allo scheletro un certo grado di flessibilità.
La cartilagine articolare, posta alle estremità delle ossa lunghe, è priva di pericondrio, ha forma di lamina ed è molto levigata in superficie, così da favorire lo scorrimento delle superfici articolari.
La cartilagine metafisaria (di accrescimento o di coniugazione) si trova nelle ossa lunghe e partecipa attivamente al loro accrescimento in lunghezza durante lo sviluppo.
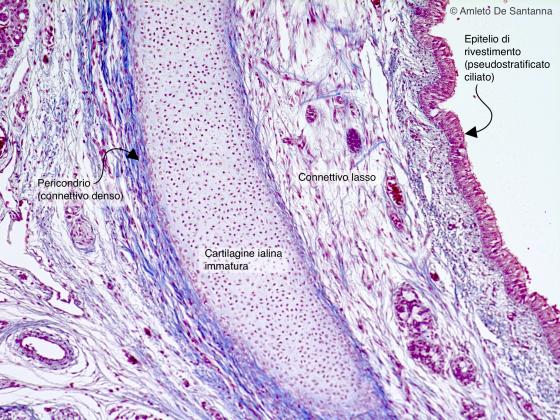
Figura C52. Trachea fetale umana. Cartilagine ialina immatura. Azan-Mallory 20x
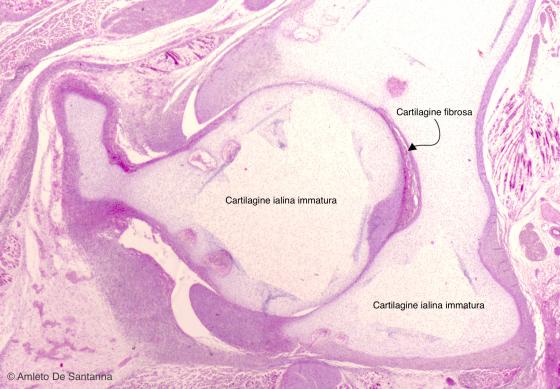
Figura C53. Articolazione coxofemorale fetale umana. Cartilagine ialina immatura. Sezione trasversale passante per l'articolazione coxo-femorale. A piccolo ingrandimento si nota l’assenza di gruppi isogeni, la morfologia e l’organizzazione delle cellule che costituiscono la cartilagine ialina immatura. Em-Eo 25x
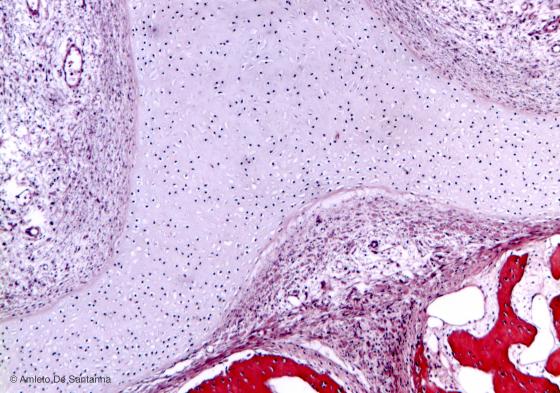
Figura C54. Fossette nasali di embrione umano. Cartilagine ialina immatura. A differenza da quella matura, questo tipo di cartilagine è riconoscibile dalle lacune di piccole dimensioni, dall'assenza di gruppi isogeni e, generalmente, dalla scarsa colorabilità della matrice extracellulare con colorazioni convenzionali. Em-Eo 40x
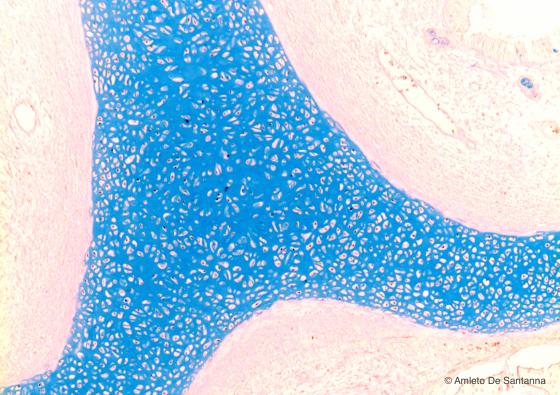
Figura C55. Fossette nasali di embrione umano. Cartilagine ialina immatura. Stessa sezione di tessuto della micrografia mostrata in Figura C53 colorata con una colorazione elettiva per le mucine acide che compongono gran parte della matrice extracellulare nel tessuto cartilagineo. Alcian blu 40x
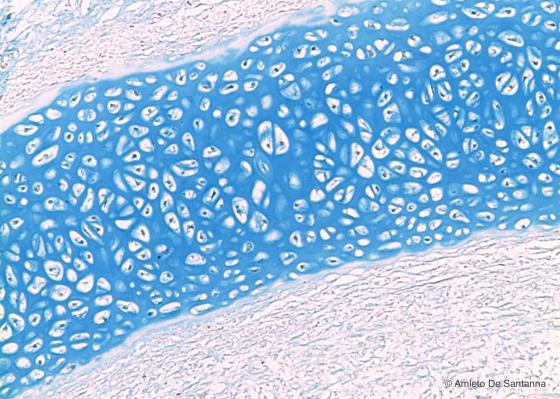
Figura C56. Fossette nasali di embrione umano. Cartilagine ialina immatura a più forte ingrandimento. A questo ingrandimento si nota la scarsità di matrice extracellulare e la totale assenza di gruppi isogeni e zone territoriali. Alcian blu 100x
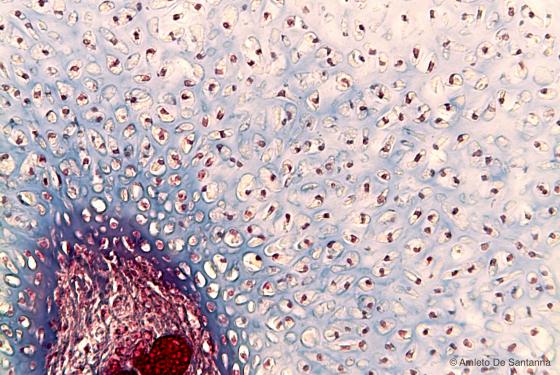
Figura C57. Piede di embrione umano. Cartilagine ialina immatura in degenerazione con un centro di ossificazione secondario. Azan-Mallory 200x
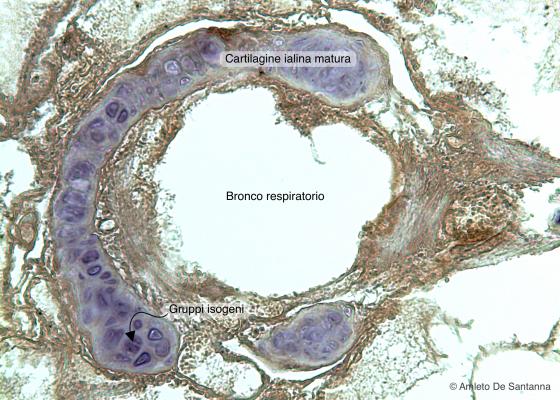
Figura C58. Polmone di delfino. Bronco polmonare in cui si distingue, colorata in viola intenso, la cartilagine ialina che forma gli anelli e le placche di sostegno. DAB-Em 100x
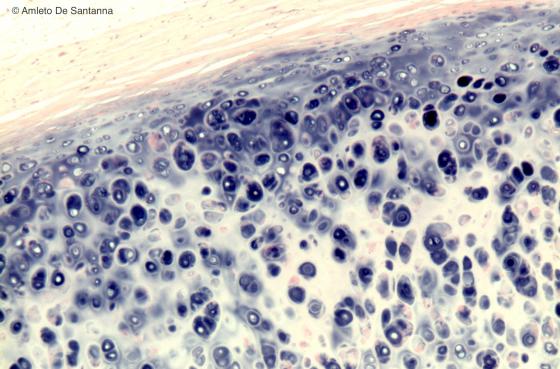
Figura C59. Trachea umana. Cartilagine ialina. Nell’architettura della cartilagine ialina matura si notano i gruppi isogeni, le zone territoriali più scure, e quelle interterritoriali più chiare. E’ evidente anche il pericondrio (colorato in rosa chiaro perché fortemente basico). La cartilagine, invece, essendo l'unico tessuto connettivale con matrice extracellulare acida, è colorata in blu-viola dall'emallume di Mayer. Em-Eo 63x
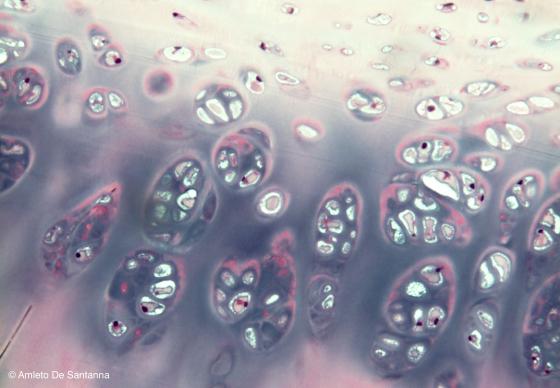
Figura C60. Trachea umana. Cartilagine ialina matura. Sono ben evidenti i gruppi isogeni formati da numerose cellule associate e la forte acidità della matrice cartilaginea colorata dall'emallume (blu-viola). Em-Eo 100x
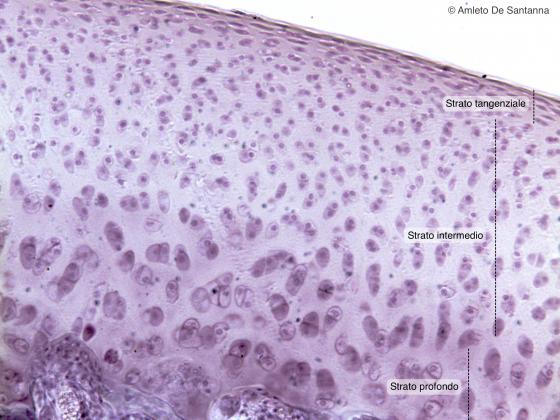
Figura C61. Testa di femore umano. Cartilagine d'incrostazione o articolare in cui notiamo la crescita per apposizione delle cellule cartilaginee. Em-Eo 100x
Cartilagine fibrosa
Si presenta sotto forma di piccole placche a confini poco distinti, costituite da condrociti, da una scarsa quantità di sostanza fondamentale e da abbondanti elementi fibrosi (collagene di tipo I). È generalmente avascolare e non presenta pericondrio. I condrociti, circondati da matrice extracellulare, sono isolati, in coppia o, talvolta, allineati gli uni sugli altri a formare una lunga fila tra i fasci di fibre collagene. Questo tipo di cartilagine rappresenta una forma di transizione tra la cartilagine ialina ed il tessuto connettivo denso, tanto che non è possibile avere un confine netto fra i due. È anche possibile, nello sviluppo embrionale come in diverse condizioni fisiologiche, che i due diversi tessuti possano gradualmente trasformarsi l’uno nell’altro.
È presente in alcune cartilagini articolari: nei dischi intervertebrali, nei dischi articolari delle articolazioni del ginocchio (menischi) e della mandibola, nell’articolazione sternoclavicolare e nella sinfisi pubica. È inoltre presente nel legamento rotondo del femore e nel punto di inserzione nell’osso di alcuni tendini.
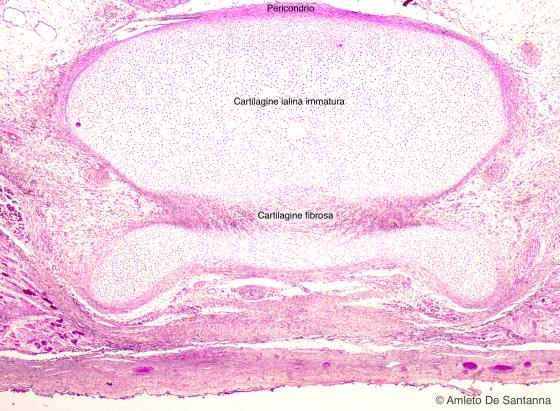
Figura C62. Vertebra fetale umana. Sezione longitudinale di vertebra in cui si apprezza l'origine della cartilagine fibrosa. Em-Eo 25x
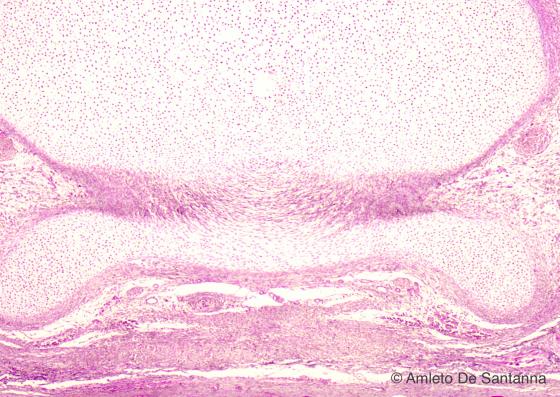
Figura C63. Vertebra fetale umana. Sezione longitudinale di vertebra a più forte ingrandimento. Em-Eo 100x
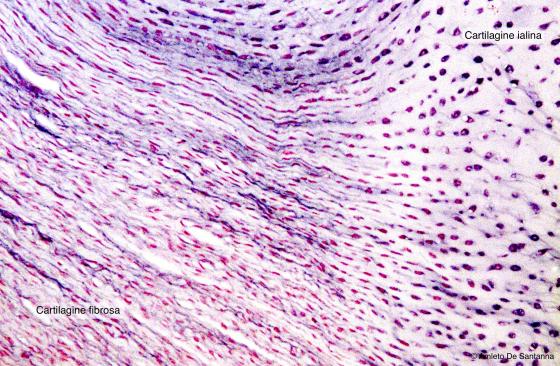
Figura C64. Disco intervertebrale umano. Zona di transizione tra cartilagine ialina e cartilagine fibrosa. La matrice extracellulare della cartilagine ialina assume un aspetto fibroso e perde gradatamente la sua acidità e, di conseguenza, anche il colore viola dell'emallume. Nella cartilagine fibrosa i condrociti tendono a diminuire, sia nel numero che nelle dimensioni. Le fibre collagene si allungano, si inspessiscono e vanno così a formare la cartilagine fibrosa. Em-Eo 100x
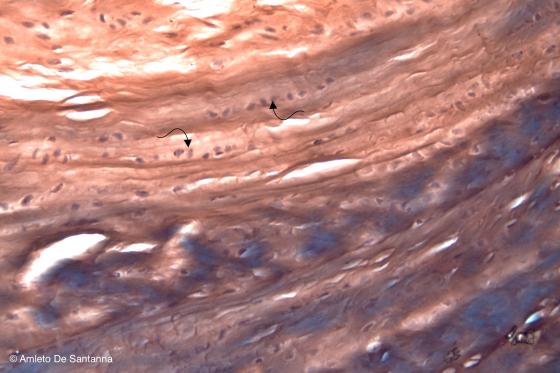
Figura C65. Disco intervertebrale umano. Le cellule cartilaginee sono alloggiate nelle lacune disposte in file parallele (frecce) e separate da denso tessuto collagene. Più il tessuto tende ad essere fibroso e più la colorazione passa dal viola, tipico della cartilagine, al rosso-marrone tipico del collagene. Em-Eo 100x
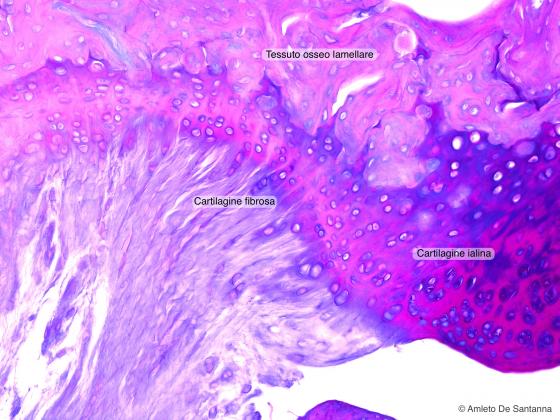
Figura C66A. Femore fetale umano. Cartilagine fibrosa. Alcian-PAS 100x
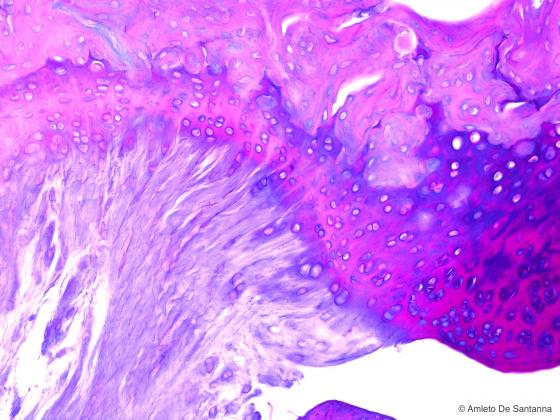
Figura C66B. Femore fetale umano. Cartilagine fibrosa. Alcian-PAS 100x
Cartilagine elastica
Le differenze più evidenti fra la cartilagine elastica e quella ialina riguardano
- la sostanza intercellulare che è molto più scarsa e povera di componente amorfa,
- la presenza di abbondanti fibre elastiche che, soprattutto nella parte profonda, si anastomizzano fra di loro a formare una rete che circonda le lacune con i condrociti (questa sottile e ramificata trama elastica può facilmente essere evidenziata con la resorcin fucsina di Weigert),
- la scarsità di gruppi isogeni, comunque formati da pochissime cellule.
La cartilagine elastica è avascolare e circondata da pericondrio.
La cartilagine elastica dà maggiore elasticità agli organi in cui è presente (epiglottide, padiglione auricolare, tuba uditiva o di Eustachio).
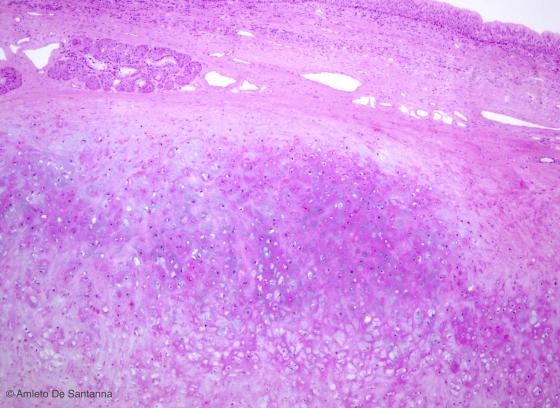
Figura C67. Epiglottide umana. Tessuto cartilagineo elastico. Con una colorazione convenzionale la cartilagine elastica si riconosce dall'assenza di gruppi isogeni anche se le lacune e i condrociti sono di grandi dimensioni. Altro carattere distintivo è la scarsa presenza di matrice extracellulare proprio per permettere l'elasticità di questo tessuto. Em-Eo 40x
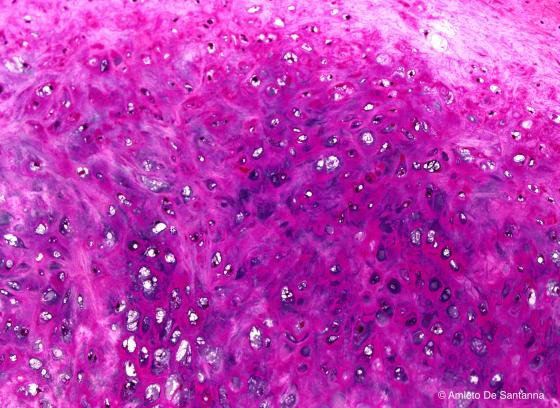
Figura C68. Epiglottide umana. Micrografia elaborata digitalmente di tessuto cartilagineo elastico a forte ingrandimento. E' evidente l'assenza di gruppi isogeni. 100x
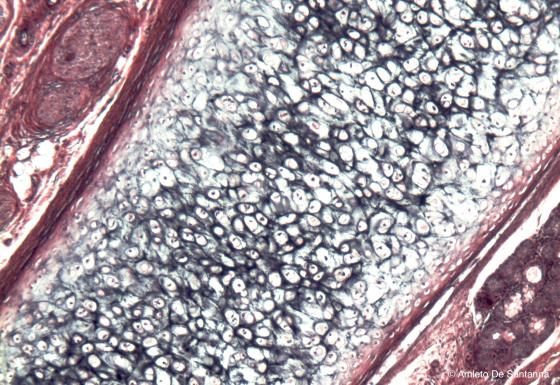
Figura C69. Epiglottide umana. Cartilagine elastica. Con una colorazione elettiva si notano le fibre elastiche della cartilagine colorate in nero intenso dalla resorcin-fucsina di Weigert. Weigert Em-Eo 63x
Cartilagine cellulare
È formata da grosse cellule cartilaginee, sferiche, addossate le une alle altre. La matrice è molto scarsa, ricca di fibre elastiche atte a opporsi alle sollecitazioni meccaniche. Esempio tipico è la cartilagine otricolare dei roditori.
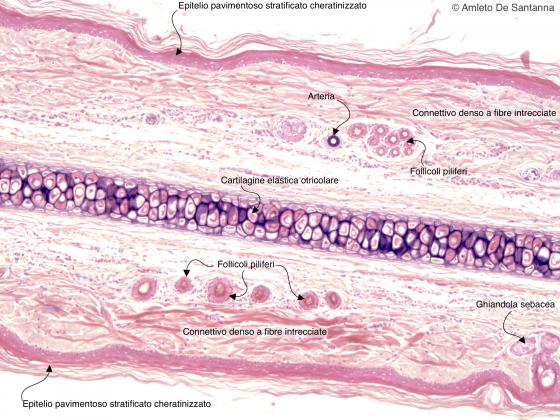
Figura C70. Padiglione auricolare di topo. La matrice elastica della cartilagine viene colorata in nero dalla resorcin fucsina di Weigert. Questa cartilagine viene detta otricolare perché presente nel padiglione auricolare dei mammiferi. La resorcin fucsina colora in nero anche la tonaca media di una piccola arteria. Weigert Em-Eo 40x
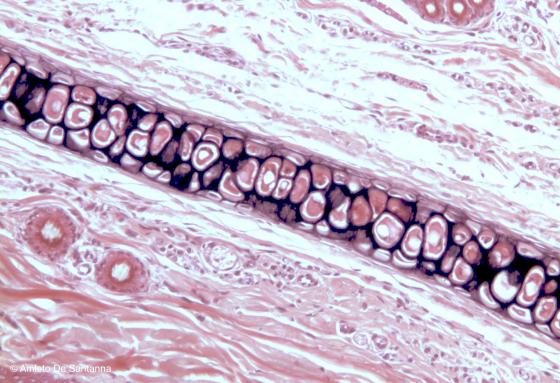
Figura C71. Padiglione auricolare di ratto a forte ingrandimento. Cartilagine elastica. Weigert Em-Eo 100x
Tessuto osseo
Il tessuto osseo è un tessuto dinamico e plastico: provvede a modulare la propria struttura in seguito a stimoli organici e meccanici. Esso è formato da una parte organica ed una parte inorganica. La parte organica è composta da cellule proprie del tessuto osseo (cellule osteoprogenitrici, osteoblasti, osteociti e osteoclasti che provvedono rispettivamente alla formazione, all’accrescimento, alla produzione, e al riassorbimento del tessuto osseo) e da matrice extracellulare (sostanza amorfa e fibre collagene di tipo I). La parte inorganica della matrice extracellulare è costituita da numerosi sali minerali come i fosfati di calcio e magnesio e i citrati di Na, Mn, K. La componente organica della matrice extracellulare rappresenta il 35% del peso secco dell’osso e ne determina robustezza ed elasticità mentre la componente inorganica mineralizzata rappresenta il 65% del peso secco e conferisce al tessuto osseo compattezza e durezza. Il tessuto osseo è soggetto a numerosi cambiamenti strutturali e funzionali dovuti all’età, all’alimentazione e alle condizioni generali dell’individuo.
Cellule del tessuto osseo
Cellule osteoprogenitrici
Sono cellule di origine mesenchimale con proprietà staminali: esse possono proliferare e differenziare in osteoblasti. Si trovano nel periostio e nell’endostio: riattivate provvedono alla formazione di nuovo tessuto osseo.
Osteoblasti
Gli osteoblasti sono i precursori degli osteociti; sono cellule voluminose, altamente polarizzate, con un nucleo ovoidale leggermente spostato in periferia e con citoplasma intensamente basofilo. Gli osteoblasti provvedono alla produzione sia della matrice organica (definita osteoide) che alla deposizione di quella inorganica, hanno quindi funzioni osteogeniche. Producono collagene di tipo I, osteocalcina, osteopontina e sialoproteina dell’osso.
Osteociti
Quando gli osteoblasti hanno terminato la formazione dell’osso rimanendo intrappolati all’interno di lacune nella matrice da loro stessi prodotta, diventano osteociti. Gli osteociti sono cellule di forma irregolare, con un nucleo ben evidente e un citoplasma che presenta diversi prolungamenti. Essi sono alloggiati nelle lacune ossee dalle quali si dipartono, in ogni direzione, numerosi canalicoli microscopici. Attraverso questi canalicoli i prolungamenti citoplasmatici di osteociti diversi prendono contatto tra di loro tramite giunzioni comunicanti e con capillari sanguigni presenti nei canali ossei, permettendo così scambi metabolici tra gli osteociti stessi e tra osteociti e sangue. Gli osteociti provvedono al mantenimento della matrice extracellulare dell’osso.
Osteoclasti
Gli osteoclasti non appartengono alla linea osteoprogenitrice ma derivano dalla fusione di numerosi precursori monocitari (fino a 30) e sono deputati alla distruzione (riassorbimento) e al rimaneggiamento del tessuto osseo. Sono cellule molto grandi, potendo superare anche i 100 µm di diametro, e hanno numerosi nuclei. Anche gli osteoclasti sono cellule altamente polarizzate: quando attivate presentano una faccia citoplasmatica in prossimità dell’osso con caratteristiche increspature molto mobili ed aderiscono alla superficie dell’osso creando un microambiente isolato da quello circostante (zona sigillata) che viene acidificato per l’attivazione successiva di enzimi di derivazione sia lisosomale (proteinasi e fosfatasi) che non lisosomale (metalloproteinasi). Questo processo porta all’erosione della matrice ossea e alla formazione di una depressione definita lacuna di Howship.
Tipologie di tessuto osseo
Il tessuto osseo si divide in due tipologie principali:
- il tessuto osseo non lamellare o trabecolare in cui la matrice extracellulare non forma lamelle; rappresenta il tessuto osseo primario ed è presente durante la vita prenatale e nell’adulto nei casi di neodeposizione ossea (ad esempio in caso di fratture);
- il tessuto osseo lamellare che costituisce la stragrande maggioranza del tessuto osseo nei mammiferi adulti ed è organizzato in lamelle.
Tessuto osseo non lamellare (o trabecolare)
Nella vita prenatale e nell’adulto in particolari condizioni la funzione del tessuto osseo non è tanto quella di assolvere al compito di forte resistenza alla pressione o alla trazione, ma piuttosto di essere il più possibile leggero, elastico e plastico.
Il tessuto osseo non lamellare si divide in tessuto osseo non lamellare a fibre intrecciate e tessuto osseo non lamellare a fibre parallele (presente prevalentemente negli uccelli).
Nel tessuto osseo non lamellare a fibre intrecciate le fibre collagene sono intrecciate a formare un fitto reticolo. La sostanza fondamentale, disposta irregolarmente, è poco rappresentata sia nella sua parte organica che inorganica. Le lacune ossee hanno forma globosa e sono tendenzialmente più grandi che nel tessuto osseo lamellare. Il tessuto osseo non lamellare a fibre intrecciate è presente anche nell’adulto a livello di suture dovute a fratture, nelle inserzioni legamentose e tendinee, sulle superfici a ridosso del periostio, in tutte le neodeposizioni di osso in generale ed in particolare nel cemento del dente.
Il tessuto osseo non lamellare a fibre parallele è invece raro nei mammiferi: lo si può trovare nelle zone di inserzione dei tendini.
Tessuto osseo lamellare
Il tessuto osseo lamellare, grazie alla sua composizione chimica e alla sua particolare organizzazione strutturale, ha una forte resistenza alla trazione, alla pressione e alle sollecitazioni meccaniche in generale. Grazie alla sua organizzazione in lamelle, infatti, questo tessuto garantisce una buona resistenza alle sollecitazioni, pur non appesantendo particolarmente lo scheletro.
Il tessuto osseo lamellare si divide in tessuto osseo lamellare compatto se è composto prevalentemente da lamelle concentriche complete, come per esempio nelle diafisi, e in tessuto osseo lamellare spugnoso se invece è composto da lamelle incomplete che formano tanti piccoli frammenti incastonati fra di loro (trabecole ossee), come per esempio nelle epifisi.
Il tessuto osseo compatto è molto duro, attraversato da numerosi canali contenenti vasi sanguigni e dotti linfatici visibili solo al microscopio.
Il tessuto osseo spugnoso si presenta come un reticolo tridimensionale di trabecole ossee che viene a delimitare uno spazio labirintico ripieno di midollo osseo.
Nelle ossa lunghe si distinguono le epifisi, corte e rotondeggianti, localizzate alle estremità e costituite prevalentemente da osso spugnoso, e una parte allungata, centrale, a forma di cilindro cavo detta diafisi, formata da osso compatto, estremamente resistente agli urti e alle pressioni e contenente midollo osseo. Nelle ossa piatte, invece, distinguiamo due superfici di tessuto osseo compatto, denominate tavolato interno ed esterno. Al centro è compreso uno strato di tessuto osseo spugnoso.
Tessuto osseo lamellare compatto
Costituisce le diafisi nelle ossa lunghe, lo strato superficiale delle epifisi, i tavolati delle ossa piatte e in generale riveste tutte le superfici ossee. Le lamelle ossee sono organizzate in strati concentrici a formare gli osteoni in cui gli osteociti sono posti circolarmente, secondo diverse orbite, intorno a canali, detti canali di Havers, contenenti uno o due piccoli capillari sanguigni. Il numero di lamelle che circonda un singolo canale di Havers può variare da 4 a 20. I vari canali di Havers comunicano tra di loro grazie ad altri canali posti, però, trasversalmente od obliquamente, detti canali di Wolkmann, anch’essi contenenti capillari sanguigni. Le sostanze nutritizie arrivano agli osteociti tramite la rete capillare e distribuite mediante la fitta rete di prolungamenti citoplasmatici che li collegano. Gli spazi che si creano fra i diversi osteoni sono occupati da frammenti di osso lamellare di forma e dimensioni variabili detti sistemi interstiziali. I confini fra gli osteoni e i sistemi interstiziali sono facilmente rilevabili da uno strato di tessuto connettivo rifrangente detto linea cementante. La superficie ossea a contatto con il periostio e l’endostio è formata da lamelle disposte parallelamente alla superficie libera dell’osso; queste lamelle sono chiamate lamelle circonferenziali.
Tessuto osseo lamellare spugnoso
È formato da lamelle incomplete associate a formare delle trabecole (come ad esempio nelle epifisi delle ossa lunghe). Questa disposizione spaziale garantisce una migliore resistenza a pressioni multidirezionali, e genera degli spazi intercomunicanti in cui è alloggiato il midollo osseo. Le lamelle sono più o meno intrecciate e di spessore variabile. Gli osteociti sono distribuiti nelle lamelle in maniera disomogenea e con grandezza e forma variabile.
Periostio
Le superfici esterne dell’osso sono rivestite da una spessa capsula connettivale costituita da tessuto connettivo denso a fibre intrecciate, il periostio. Esso ha il compito di proteggere l’osso e di supportare l’azione trofica mediata dai vasi sanguigni di cui è ricco. Nella faccia esterna del periostio sono presenti poche cellule e molte fibre collagene (strato fibroso), nella faccia interna , invece, vi sono poche fibre, numerosi capillari sanguigni e cellule osteoprogenitrici con potenziale osteogenico (strato osteogenico). Dal periostio si dipartono trasversalmente, verso il tessuto osseo, fibre connettivali, dette fibre di Sharpey, che hanno il compito, addentrandosi nel sistema di lamelle circonferenziali esterne, di fornire un buon sistema di ancoraggio all’osso. Il periostio non è presente nelle articolazioni e nei punti di inserzione di muscoli e legamenti.
Endostio
L’endostio è formato da uno strato di cellule pavimentose e fibre connettivali che ricoprono tutte le superfici interne dell’osso (trabecole ossee dell’osso spugnoso, cavità midollari dell’osso compatto, canali di Havers e di Wolkmann). Le cellule che formano l’endostio hanno un alto potenziale osteogenico.
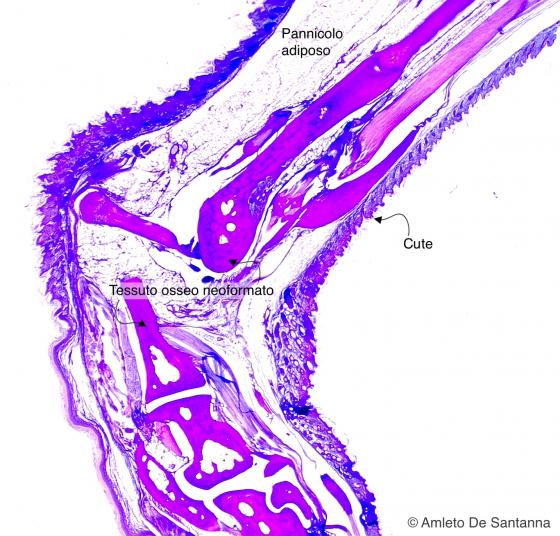
Figura C72. Arto anteriore di topo. Alcian-PAS 40x
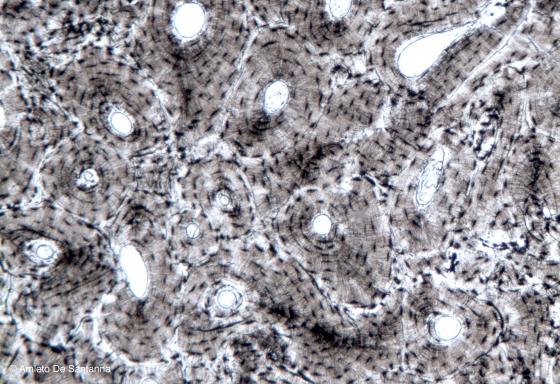
Figura C73. Osso umano. Sezione trasversale di osso non colorato in cui si notano le lamelle del tessuto osseo lamellare compatto. 63x
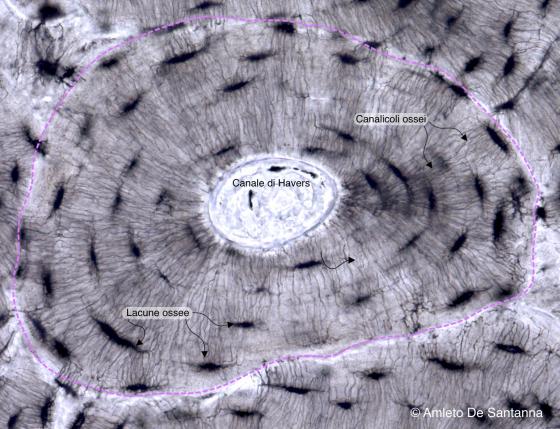
Figura C74. Osso umano. Singolo osteone a più forte ingrandimento (tratteggiato in rosa) in cui è ben evidenziato il sistema lamellare concentrico che circonda il canale di Havers. Nell'osso del vivente gli osteociti prendono rapporto tra di loro mediante sottili prolungamenti citoplasmatici. Nel preparato possiamo apprezzare le cavità occupate dagli osteociti (lacune ossee) ed i canalicoli in cui passano i prolungamenti citoplasmatici degli osteociti (canalicoli ossei). 160x
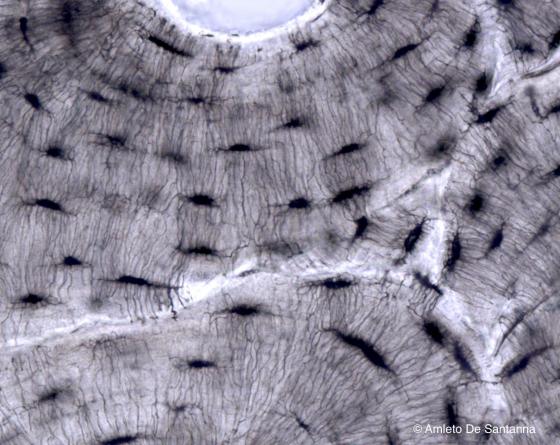
Figura C75. Osso umano. Canalicoli ossei a più forte ingrandimento. 400x
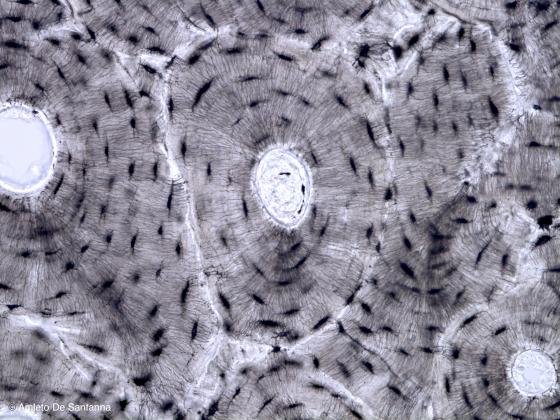
Figura C76. Osso umano. Osso lamellare compatto ottenuto per sfregamento e assottigliamento abrasivo non colorato di tessuto osseo. 100x
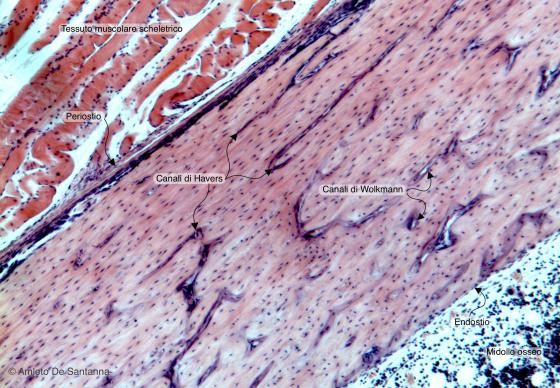
Figura C77A. Femore umano. Tessuto osseo lamellare compatto in sezione longitudinale in cui non si possono apprezzare i sistemi Haversiani lamellari. Invece, si notano chiaramente sia i canali di Havers in sezione longitudinale che i canali di Volkmann, posti trasversalmente o obliquamente rispetto ai primi, in sezione trasversale. Em-Eo 40x
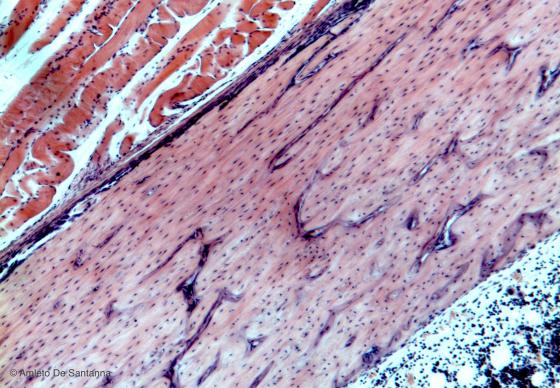
Figura C77B. Femore umano. Tessuto osseo lamellare compatto in sezione longitudinale. Em-Eo 40x
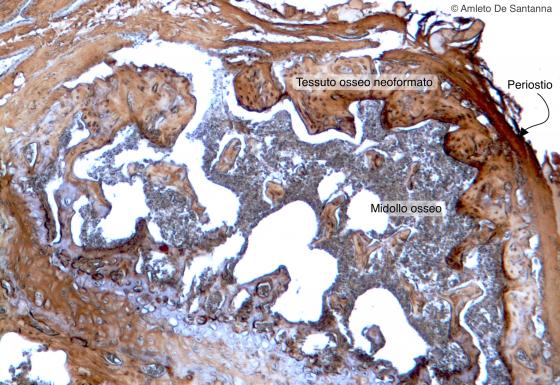
Figura C78. Femore di topo. Epifisi di femore tagliata trasversalmente. L'ossificazione endocondrale è terminata, si notano le trabecole di osso lamellare spugnoso con, all'interno, il midollo osseo. Em-Dab 63x
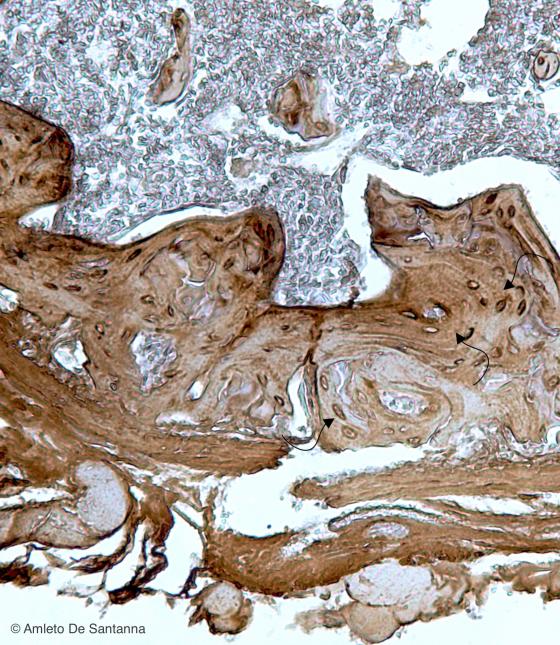
Figura C79. Femore di topo a più forte ingrandimento in cui si riconosce l'organizzazione lamellare delle trabecole dell'osso spugnoso (frecce). HRP-DAB 100x
Osteogenesi
L’osteogenesi o ossificazione è il processo che porta alla formazione di tessuto osseo. Questo processo avviene partendo da tessuto mesenchimale preesistente che viene trasformato in tessuto osseo.
Abbiamo due tipi di osteogenesi:
- l’ossificazione diretta o intramembranosa, in cui il tessuto osseo è formato a partire da tessuto mesenchimale,
- l’ossificazione indiretta o condrale, in cui il tessuto osseo è formato a partire da cartilagine ialina.
Entrambi i tipi di ossificazioni danno origine ad osso non lamellare che viene poi trasformato in osso lamellare.
Ossificazione diretta
Durante il processo di ossificazione diretta o intramembranosa le cellule mesenchimali dell’embrione si organizzano in aggregati (centri di ossificazione) dove si differenziano in osteoblasti che depositano tessuto osteoide (matrice extracellulare dell’osso), successivamente mineralizzato a formare tessuto osseo primitivo anche detto tessuto osseo non lamellare a fibre intrecciate che verrà poi sostituito, in seguito a rimodellamento, da tessuto osseo lamellare. Esempi di ossificazione intramembranosa sono quelli delle ossa craniche frontale, parietali, parte delle ossa temporali e mascellare.
Nella mandibola il processo di ossificazione diretta (definita ossificazione mantellare) è iniziato e guidato dalla presenza di un bottone cartilagineo che funge da catalizzatore e permette la trasformazione del tessuto mesenchimale circostante in tessuto osseo. In modelli murini l’asportazione chirurgica del bottone cartilagineo provoca la mancata ossificazione della mandibola.
Ossificazione indiretta o encondrale
Quando il processo di ossificazione avviene tramite un passaggio cartilagineo intermedio viene detto ossificazione indiretta o encondrale. Questo tipo di ossificazione è tipico delle ossa lunghe, di quelle della colonna vertebrale, del bacino, di parte di quelle facciali e delle coste. Per il meccanismo da cui prende origine questo tipo di ossificazione viene detto “osso di sostituzione”. L’osso calcificato riflette grosso modo la stessa architettura del precedente modello cartilagineo, variando sensibilmente solo nelle dimensioni.
L’ossificazione indiretta avviene secondo due modalità differenti:
- l’ossificazione pericondrale
- l’ossificazione endocondrale
Ossificazione pericondrale
Nel modello cartilagineo si assiste ad un ispessimento del pericondrio presente sulla diafisi (parte lunga dell’osso) per un aumento sensibile degli osteoblasti presenti nella capsula connettivale. Successivamente iniziano a penetrare all’interno della cartilagine vasi che portano altri osteoblasti insieme a condroclasti adibiti alla distruzione del tessuto cartilagineo. Si forma dall’esterno verso l’interno della diafisi una sottile trama reticolare che fornirà il primo modello di tessuto osteoide (centro di ossificazione primario). Gran parte del tessuto cartilagineo degenera mentre incomincia a depositarsi tessuto osseo neoformato. Questo processo avviene mediante la formazione di un fronte di ossificazione in cui le cellule cartilaginee si dispongono lungo colonne, disperdono la cromatina e si ipertrofizzano fino a distruggersi. Contemporaneamente gli osteoblasti del fronte opposto depositeranno negli spazi intracellulari tessuto osteoide che, successivamente, si organizzerà in lamelle e formerà il tessuto osseo vero e proprio. Si otterrà in questo modo l’allungamento del modello osseo.
Ossificazione endocondrale
Quando gran parte della diafisi è ossificata i vasi penetrano prima in una epifisi (quella prossimale), e successivamente nell’altra, formando i centri di ossificazione secondaria. In questa seconda fase la deposizione del tessuto osteoide comincia dall’interno del modello epifisario e procede verso l’esterno permettendo un accrescimento dell’osso in larghezza.
Nella diafisi, intanto, si assisterà ad un rimodellamento del tessuto osseo già formatosi, ad opera di macrofagi, permettendo in questo modo agli osteoblasti presenti nell’endostio la deposizione di altro tessuto osteoide. Questo provocherà un aumento dello spessore della diafisi stessa.
Alla fine del processo di ossificazione indiretta si assisterà al riassorbimento dei due strati di cartilagine epifisaria, prima di quello inferiore e poi di quello superiore.
Fasi dell’ossificazione indiretta
Il processo di ossificazione indiretta si realizza per fasi successive. Esempio tipico ne è l’ossificazione a livello della metafisi dell’osso lungo. Si distinguono diverse zone:
- Zona della cartilagine a riposo o di riserva, è formata da condrociti di riserva che confinano con l’epifisi.
- Zona di proliferazione, è formata da condrociti in attiva fase proliferativa che si dispongono in colonne.
- Zona di maturazione, è formata da condrociti che aumentano di dimensione.
- Zona ipertrofica, qui i condrociti hanno raggiunto la loro dimensione massima, la matrice extracellulare viene progressivamente calcificata riducendone la permeabilità alle sostanze nutritizie.
- Zona di degenerazione, la calcificazione della matrice porta a degenerazione dei condrociti. Gli spazi delle lacune lasciate vuote vengono popolati da vasi sanguigni e da cellule osteoprogenitrici che poi si raggruppano sulle formazioni di cartilagine calcificata residue e su cui depositeranno tessuto osseo non lamellare a fibre intrecciate che successivamente si riorganizzerà in tessuto osseo lamellare.
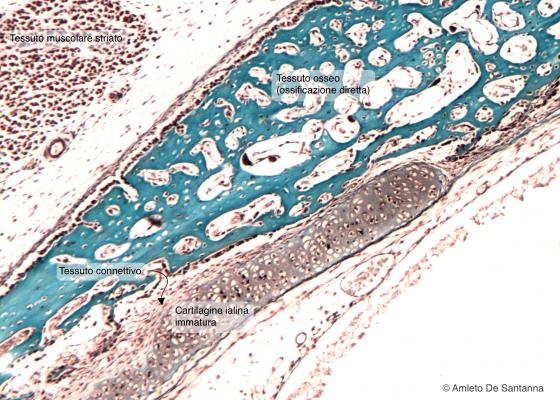
Figura C80. Cranio fetale umano. Ossificazione diretta o intramembranosa di osso piatto. Questa ossificazione avviene tramite passaggio diretto da cellule mesenchimali a tessuto osseo (azzurro). Nonostante vi sia presenza di cartilagine non esiste continuità (fronte di ossificazione) fra tessuto osseo e tessuto cartilagineo, divisi da tessuto connettivo capsulare. Quindi non possiamo assolutamente parlare di ossificazione indiretta encondrale ma di ossificazione diretta intramembranosa. Mallory 63x

Figura C81. Cranio fetale umano. Ossificazione diretta o intramembranosa di osso piatto a più forte ingrandimento. Le trabecole ossee sono colorate in rosso. Azan-Mallory 63x
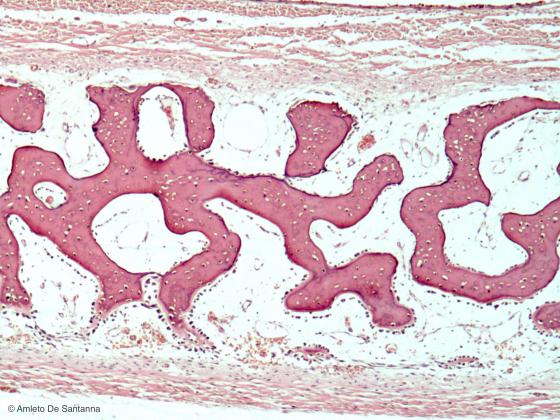
Figura C82. Cranio di feto umano. Ossificazione diretta intramenbranosa di un osso piatto. Notare la totale assenza di tessuto cartilagineo. Em-Eo 63x
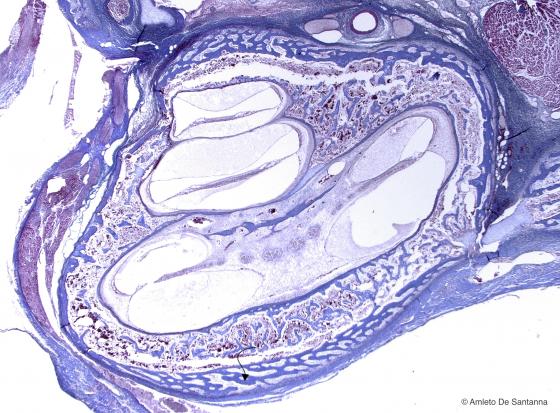
Figura C83. Osso temporale di feto umano. Ossificazione diretta o intramembranosa (freccia). Azan-Mallory 63x
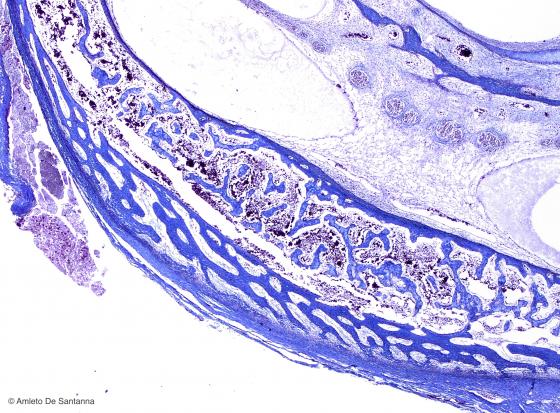
Figura C84. Osso temporale di feto umano a più forte ingrandimento. Ossificazione diretta o intramembranosa. Si nota in blu il tessuto osteoide neoformato direttamente dal mesenchima. Azan-Mallory 200x
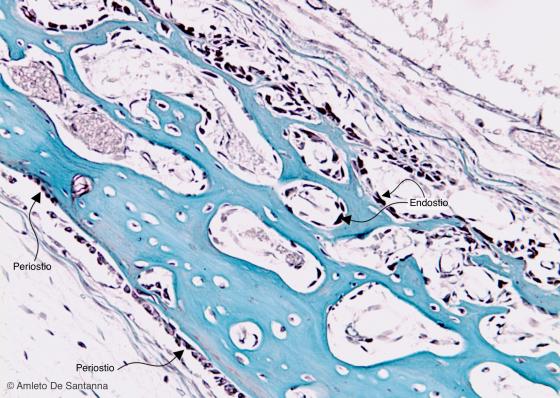
Figura C85. Cranio fetale umano. Ossificazione diretta o intramembranosa. Si notino le linee interna (dell'endostio) ed esterna (del periostio) di cellule osteogenitrici. Mallory 100x
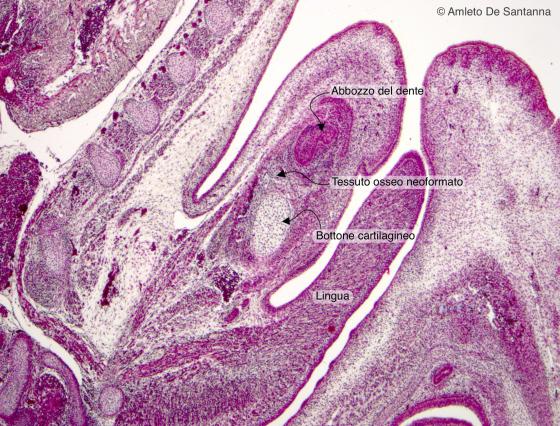
Figura C86. Feto di topo. Ossificazione diretta mantellare. Questo tipo di ossificazione è specifico della mandibola. Questo preparato mostra un primissimo stadio di ossificazione in cui si nota il bottone cartilagineo estremamente sviluppato e il mesenchima che incomincia a trasformarsi in tessuto osteoide (tessuto osseo neoformato). Azan-Mallory 25x
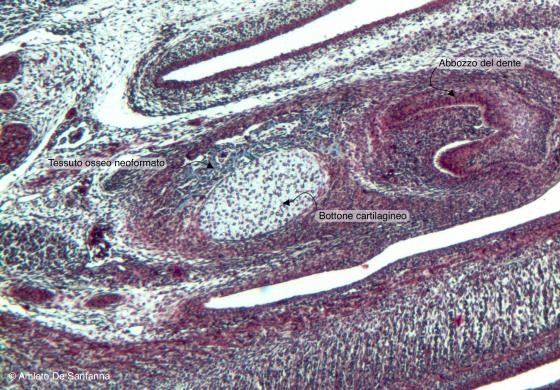
Figura C87. Mandibola di feto di topo. Primissime fasi del processo di ossificazione diretta di tipo mantellare. Al centro notiamo il bottone cartilagineo, più chiaro, con sopra tessuto osseo neoformato, colorato in azzurro. A destra si vede l'abbozzo di un dente. Azan-Mallory 63x
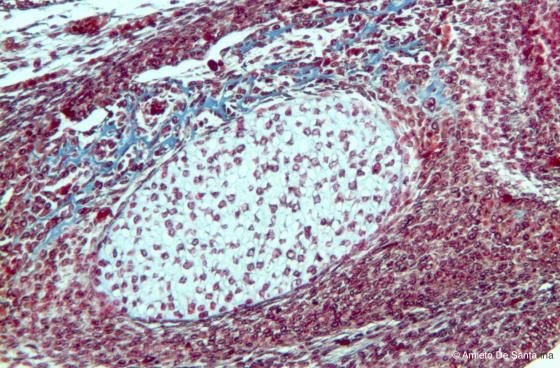
Figura C88. Mandibola di feto di topo a più forte ingrandimento in cui si nota chiaramente, in colore azzurro, il tessuto osseo neoformato da cui originerà la mandibola. Azan-Mallory 100x
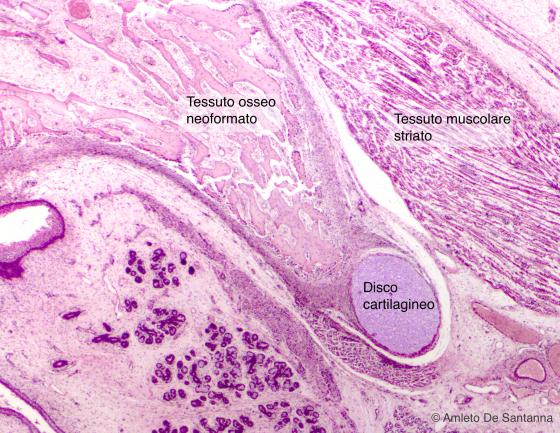
Figura C89. Mandibola fetale umana. Ossificazione diretta mantellare ad uno stadio più avanzato. Em-Eo 25x
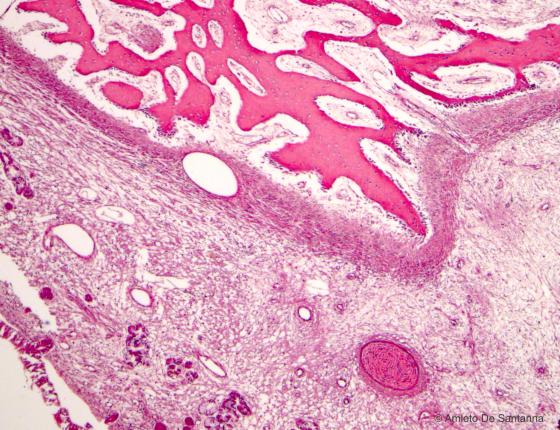
Figura C90. Mandibola fetale umana. Ossificazione diretta mantellare in feto a termine. Si nota il bottone cartilagineo che sta cominciando a regredire. Em-Eo 40x
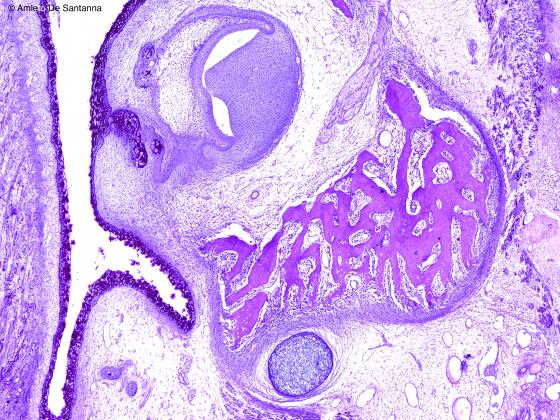
Figura C91. Mandibola fetale umana. Ossificazione diretta mantellare colorata immunoistochimicamente per mettere in evidenza i diversi mucopolisaccaridi componenti il tessuto cartilagineo (blu, acido) e il tessuto osseo (magenta). Alcian-PAS 40x
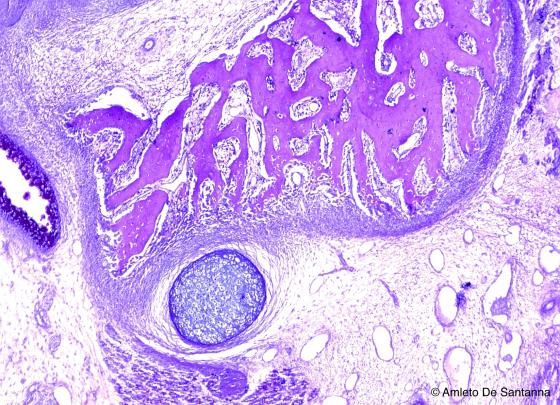
Figura C92. Mandibola fetale umana. Ossificazione diretta mantellare colorata immunoistochimicamente a maggiore ingrandimento. Alcian-PAS 63x
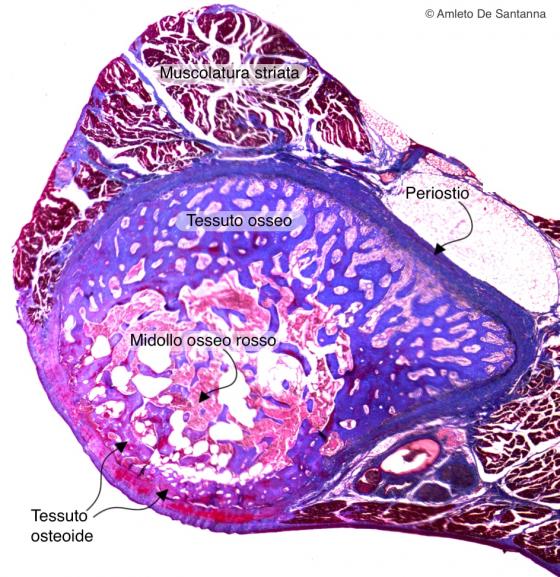
Figura C93. Costa fetale umana. Ossificazione diretta di costa umana. Nelle coste si hanno entrambi i tipi di ossificazione: diretta e indiretta. Per distinguerli bisogna guardare se vi è continuità tra tessuto cartilagineo e tessuto osseo (ossificazione indiretta) o se vi è discontinuità tra i due tessuti oppure assenza di cartilagine (ossificazione diretta). Il tessuto osteoide (tessuto osseo immaturo, non calcificato) si riconosce per la colorazione rossa dell'azocarminio mentre il tessuto osseo calcificato si riconosce per la colorazione blu data dal blu di anilina. Azan-Mallory 40x
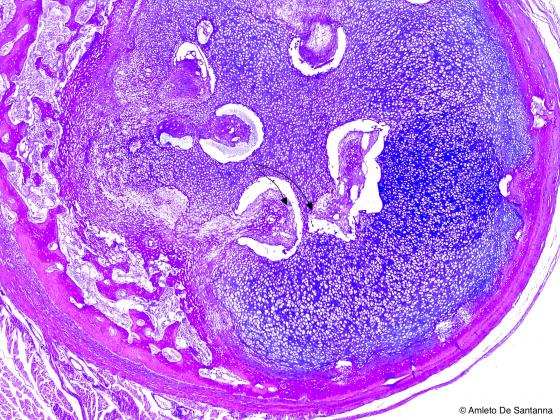
Figura C94. Costa fetale umana. Ossificazione indiretta di costa umana. Si notino i nuclei di ossificazione secondaria endocondrale (frecce). Alcian-PAS 25x
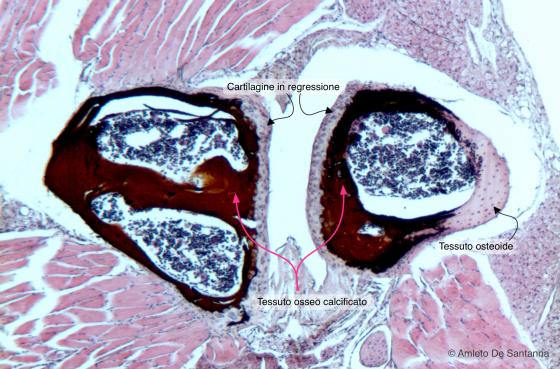
Figura C95. Vertebre di topo. Vertebre non decalcificate di topo in fase di ossificazione. Porzione di vertebra con ossificazione indiretta. Si nota infatti la continuità fra il tessuto cartilagineo (in viola) e quello osseo (in marrone-nero). I sali inorganici sono messi in evidenza dalla colorazione marrone-nera dell'Ag metallico precipitato. Nelle porzioni di tessuto osseo colorate in rosa non vi è ancora matrice inorganica depositata. Von Kossa-Em-Eo 63x
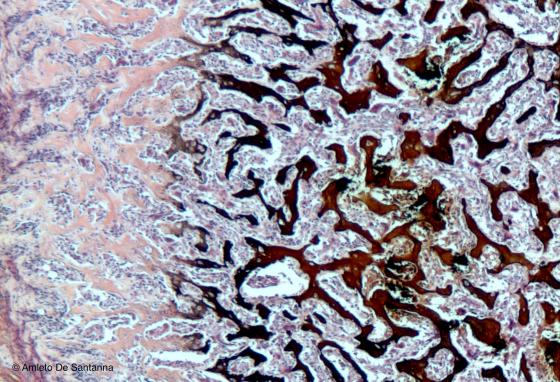
Figura C96. Tibia di feto umano. Epifisi di tibia non decalcificata e tagliata trasversalmente. A destra le trabecole di osso spugnoso sono costituite da matrice mineralizzata (colorata in marrone nero), a sinistra, invece, le trabecole sono ancora prive di materiale inorganico per cui appaiono rosa pallido. All'interno delle trabecole abbiamo midollo osseo rosso. Colorazione specifica per il tessuto osseo mineralizzato. Von Kossa-Em-Eo 63x
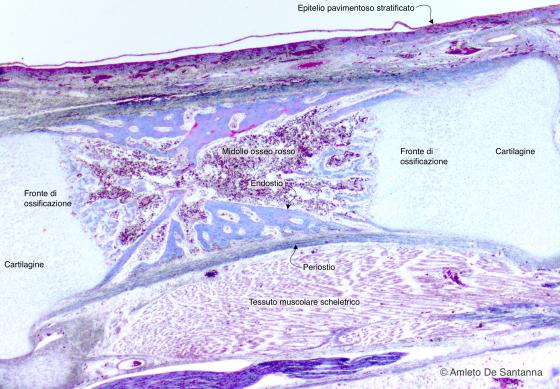
Figura C97A. Piede fetale umano. Ossificazione indiretta pericondrale delle ossa lunghe. L'ossificazione indiretta pericondrale è così denominata perché l'ossificazione procede a partire dal manicotto periostiale verso l'interno. Azan-Mallory 25x

Figura C97B. Piede fetale umano. Ossificazione indiretta pericondrale delle ossa lunghe. L'ossificazione indiretta pericondrale è così denominata perché l'ossificazione procede a partire dal manicotto periostiale verso l'interno. Azan-Mallory 25x

Figura C98. Piede fetale umano. Ossificazione indiretta pericondrale delle ossa lunghe. Alcian-PAS 40x
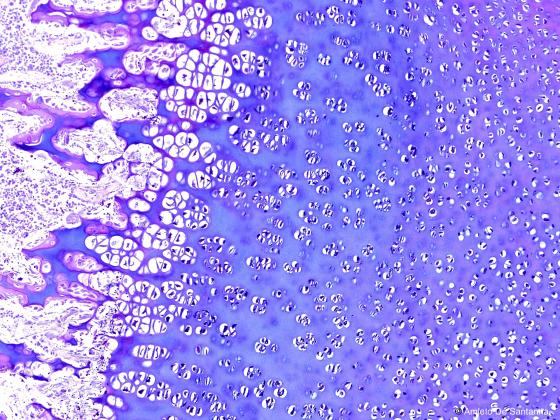
Figura C99. Piede fetale umano. Ossificazione indiretta pericondrale delle ossa lunghe a più forte ingrandimento. Alcian-PAS 100x
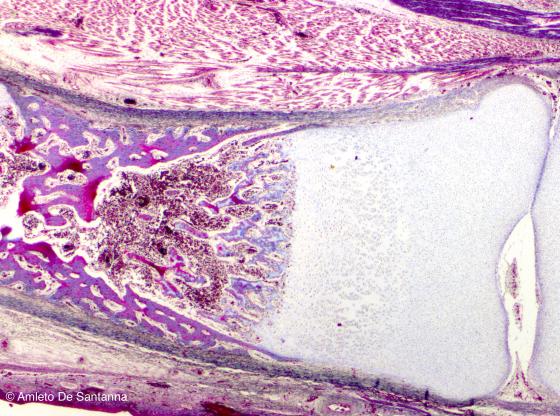
Figura C100. Piede fetale umano. Ossificazione indiretta pericondrale delle ossa lunghe. Azan-Mallory 40x
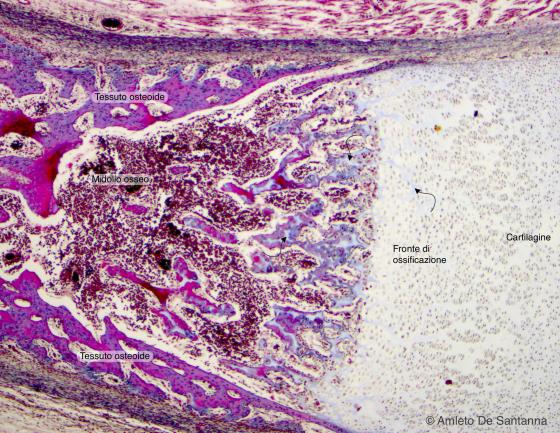
Figura C101. Piede fetale umano. Ossificazione indiretta pericondrale delle ossa lunghe a forte ingrandimento. Le frecce indicano la matrice extracellulare in disfacimento. Azan-Mallory 63x

Figura C102A. Femore umano. Ossificazione indiretta. Fronte di ossificazione. La micrografia mostra in alto i condrociti appiattiti e impilati a formare delle colonne (zona proliferativa); in posizione intermedia il fronte di ossificazione formato da lacune con condrociti in necrosi e da osteoblasti che depositano la matrice ossea (zona ipertrofica); in basso, in azzurro i residui cartilaginei, in rosa, il tessuto osseo neoformato, circondato da capillari (zona di degenerazione). Em-Eo 100x

Figura C102B. Femore umano. Ossificazione indiretta. Fronte di ossificazione. La micrografia mostra in alto i condrociti appiattiti e impilati a formare delle colonne (zona proliferativa); in posizione intermedia il fronte di ossificazione formato da lacune con condrociti in necrosi e da osteoblasti che depositano la matrice ossea (zona ipertrofica); in basso, in azzurro i residui cartilaginei, in rosa, il tessuto osseo neoformato, circondato da capillari (zona di degenerazione). Em-Eo 100x
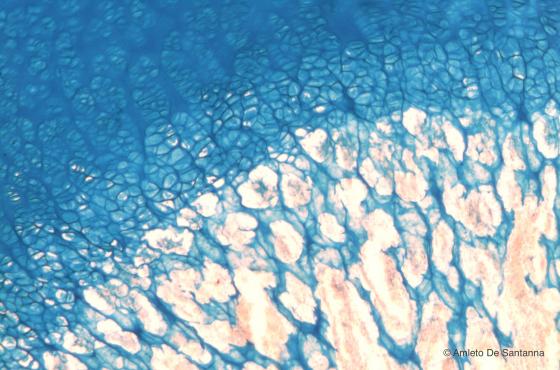
Figura C103. Femore di feto umano. Sezione tangenziale del fronte di ossificazione. In alto si notano le cellule della cartilagine ancora organizzata in gruppi isogeni e la matrice fortemente acida; al centro i condrociti impilati a formare delle colonne con la matrice debolmente acida; in basso i residui di matrice cartilaginea acida (colorata in azzurro) e la primissima formazione di tessuto osteoide (in rosa pallido). Alcian Blu 63x
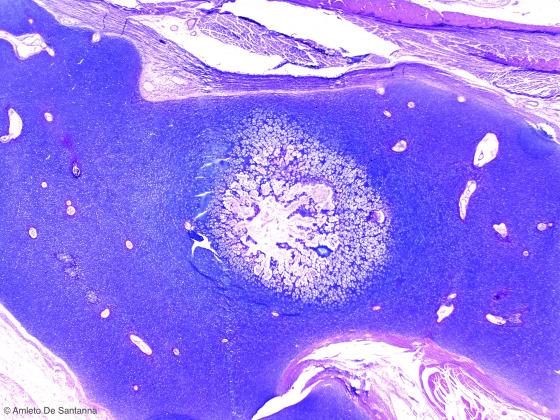
Figura C104. Tallone di feto umano. Ossificazione indiretta endocondrale. Alcian-PAS 25x.
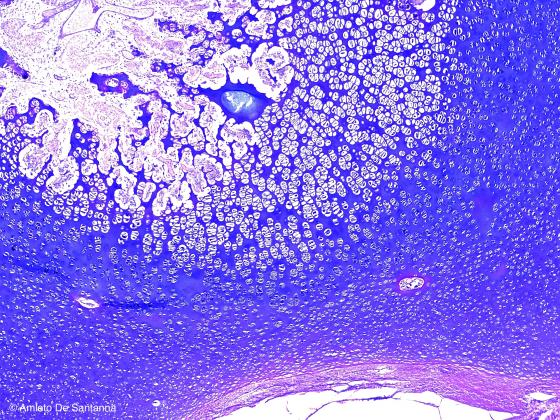
Figura C105. Tallone di feto umano. Ossificazione indiretta endocondrale. Alcian-PAS 40x.
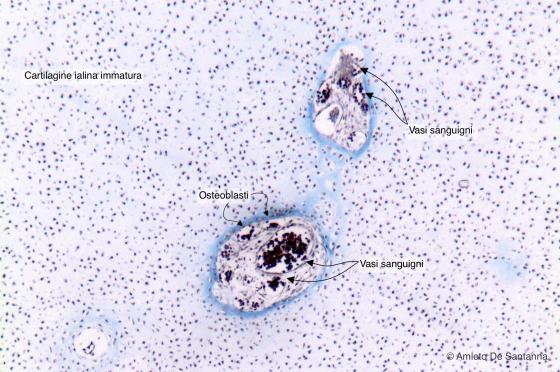
Figura C106. Epifisi di osso lungo umano. Nuclei di ossificazione secondaria. La cartilagine è l'unico tessuto connettivo che non è vascolarizzato per cui al comparire di vasi sanguigni si ha sicuramente un processo di ossificazione. Questa è una sezione di tibia umana ottenuta tagliando trasversalmente l'epifisi inferiore. Al centro si notano, immersi in tessuto cartilagineo ialino immaturo, i primi centri di ossificazione secondaria endocondrale. Azan-Mallory 63x
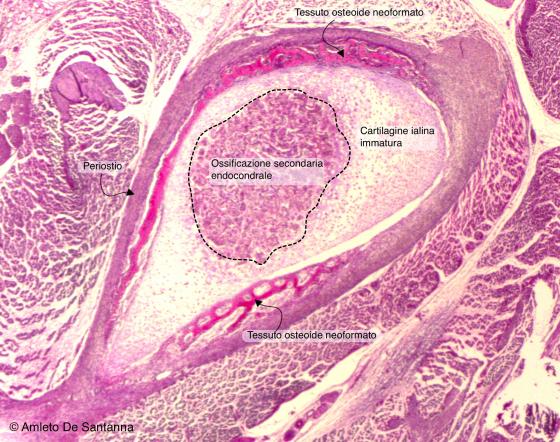
Figura C107. Femore (epifisi) di feto umano. Ossificazione indiretta endocondrale. Nelle ossa lunghe l'ossificazione secondaria endocondrale avviene iniziando dalla parte centrale dell'epifisi ed estendendosi progressivamente verso la periferia, rendendo possibile l'accrescimento dell'osso in larghezza. Em-Eo 25x
Tessuto linfoide
l tessuto linfoide è un particolare tessuto connettivo caratterizzato dall’essere composto in gran parte da cellule, i La cartilagine, a seconda delle caratteristiche della matrice extracellulare e quindi della sua funzione, si divide nelle seguenti tre tipologie principali:, sostenute da una fitta rete connettivale. Le cellule che compongono il tessuto linfoide vengono generate in organi detti organi linfoidi primari, si spostano nei diversi distretti corporei mediante la circolazione sanguifera e linfatica (e quindi nel contesto dei tessuti connettivi sangue e linfa), possono sostare in altri organi linfoidi detti secondari ed infine possono extravasare e migrare attraverso il tessuto connettivo lasso. Da quanto detto si evince che le cellule che compongono il tessuto linfoide possono trovarsi nel contesto di svariati tipi di tessuto connettivo. Questo perché la loro funzione non è quella tipica del tessuto connettivo (cioè trofica e di sostegno) bensì quella di difendere l’organismo dall’attacco dei più disparati agenti patogeni. Questa funzione rende necessaria la capacità di ricircolare in tutti i distretti corporei e di raggiungere le zone dove è presente il patogeno da contrastare.
I linfociti sono cellule generalmente piccole, occupate da un nucleo centrale, rotondo, molto evidente, circondato da un sottile anello di citoplasma. La caratteristica morfologica principale di queste cellule, oltre alle piccole dimensioni, è sicuramente quella di essere molto colorabili, indifferentemente dal metodo di colorazione usato. Per svolgere adeguatamente la propria funzione i linfociti hanno la caratteristica di essere molto mobili. Possiamo ritrovare queste cellule isolate o, il più delle volte, aggregate in formazioni più o meno organizzate.
Gli organi linfoidi si dividono in organi linfoidi primari (detti anche centrali) e organi linfoidi secondari (detti anche periferici).
Gli organi linfoidi primari sono, nell’uomo, il midollo osseo ed il timo (nella vita fetale, il fegato e la milza). Negli uccelli è presente un organo linfoide primario particolare, localizzato nell’intestino, chiamato borsa di Fabrizio. Gli organi linfoidi secondari sono la milza, i linfonodi, il tessuto linfoide associato alle mucose (MALT: tonsille, placche di Peyer, appendice cecale e altri raggruppamenti linfocitari sparsi nelle mucose).
Negli organi linfoidi primari hanno luogo tutte le tappe differenziative che, a partire dalle cellule staminali già orientate verso la linea linfoide, portano alla produzione di linfociti vergini maturi (B nel midollo osseo; T nel timo) (fase antigene indipendente).
Gli organi linfoidi secondari sono la sede in cui i linfociti svolgono le loro funzioni dopo attivazione in seguito ad incontro con l’antigene (fase antigene dipendente).
Abbiamo principalmente due tipi di linfociti:
- i linfociti B che sono generati e maturano nel midollo osseo (negli uccelli si generano e maturano nella borsa di Fabrizio, da qui il loro nome);
- i linfociti T che sono generati nel midollo osseo ma che maturano nel timo (da cui il loro nome).
È presente anche una terza classe di linfociti, inizialmente definiti non B e non T perché non riconducibili a caratteristiche fenotipiche proprie dei linfociti B o T, definiti successivamente linfociti Natural Killer (NK).
Una volta ultimato il processo maturativo, i linfociti migrano verso gli organi linfoidi secondari o periferici e cioè milza, linfonodi, tessuto linfoide associato alle mucose (MALT) in modo da poter assolvere al loro compito di riconoscimento e aggressione di agenti microbici. La milza, oltre a svolgere una funzione immunitaria, ha anche una funzione emocateretica, cioè di distruzione di globuli rossi immaturi o non funzionali. Questo processo avviene nella polpa rossa.
Midollo osseo
Il midollo osseo, nell’uomo, è il principale organo emopoietico. Il midollo osseo è formato da tessuto linfoide ed è chiamato così perché alloggiato nelle cavità interne delle ossa, sia lunghe che piatte. In condizioni normali svolge una funzione primaria nella produzione e maturazione delle cellule del sangue. Il midollo osseo con funzione ematopoietica viene detto midollo osseo rosso perché, in vivo, a causa della forte presenza di sangue ed eritrociti, appare di colore rosso vivo.
Il midollo osseo, all’inizio della vita fetale, compare dapprima nella clavicola per poi diffondersi in tutte le altre ossa. Durante lo sviluppo fetale e per un periodo di diversi anni abbiamo prevalentemente midollo osseo rosso. Dopo lo sviluppo dell’individuo gran parte del midollo perde le sue proprietà emopoietiche mentre aumenta la componente adipocitaria e connettivale che fa cambiare il suo colore fino a diventare bianco-giallino, abbiamo quindi il midollo osseo giallo. Questo fa sì che, nell’adulto, la funzione emopoietica, e quindi la presenza di midollo osseo rosso, sia ristretta ad alcune zone della diploe della volta cranica, dello sterno, delle coste, delle creste iliache e alle parti centrali di alcune ossa brevi.
Nel midollo osseo riconosciamo:
- il tessuto di supporto, formato da cellule connettivali, i reticolociti, che con le loro fibre argirofile formano una fitta trama reticolare che sostiene le cellule del tessuto emopoietico e forma un sistema reticolare spugnoso che ne facilita il passaggio e la migrazione;
- il comparto emopoietico, ricco di cellule a vario stadio di maturazione (eritrociti, granulociti neutrofili, granulociti basofili, granulociti eosinofili, linfociti, monociti, megacariociti, piastrine);
- il comparto vascolare, costituito da seni venosi o sinusoidi che, oltre ad avere funzione trofica, permettono la costante migrazione nel torrente circolatorio di eritrociti ed altri elementi figurati del sangue. Addossati ai sinusoidi troviamo i megacariociti, grosse cellule che per gemmazione e distacco di parte del citoplasma producono le piastrine.
È difficile ottenere preparati istologici di midollo osseo a causa dell’estrema delicatezza intrinseca di questo tessuto. Dopo opportuna fissazione e decalcificazione del tessuto osseo si possono ottenere sezioni al microtomo, oppure si possono ottenere discreti preparati per schiacciamento o tramite strisci di frammenti di tessuto. Le colorazioni più usate sono quelle tipiche del sangue: Em-Eo o May Grumwald-Giemsa.
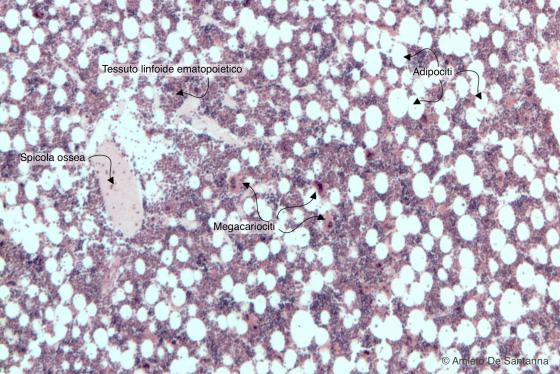
Figura C108A. Midollo osseo rosso umano. Il tessuto ematopoietico è colorato in rosso-viola, gli adipociti, essendo stata estratta la gocciolina lipidica da solventi usati per la processazione del preparato, risultano incolori. Em-Eo 40x
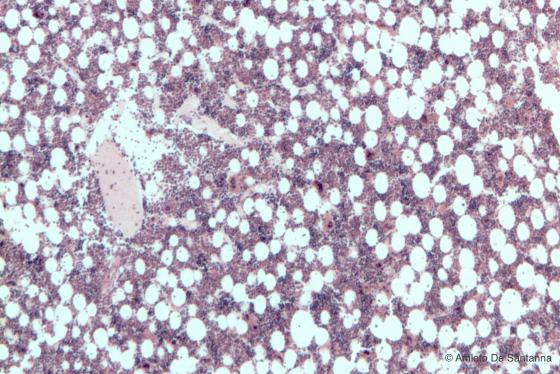
Figura C108B. Midollo osseo rosso umano. Il tessuto ematopoietico è colorato in rosso-viola, gli adipociti, essendo stata estratta la gocciolina lipidica da solventi usati per la processazione del preparato, risultano incolori. Em-Eo 40x
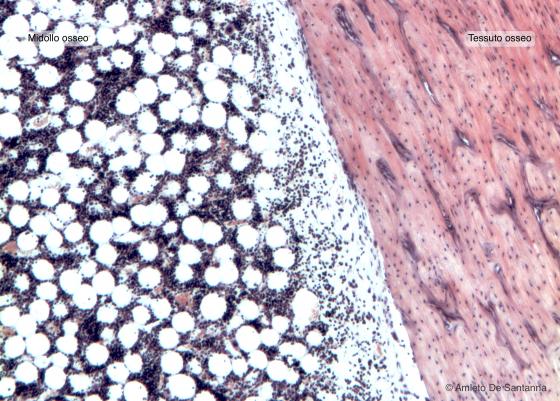
Figura C109. Midollo osseo umano in situ. Sezione longitudinale di osso lungo con, all'interno, midollo osseo rosso composto da tessuto emopoietico misto a tessuto adiposo. Em-Eo 63x
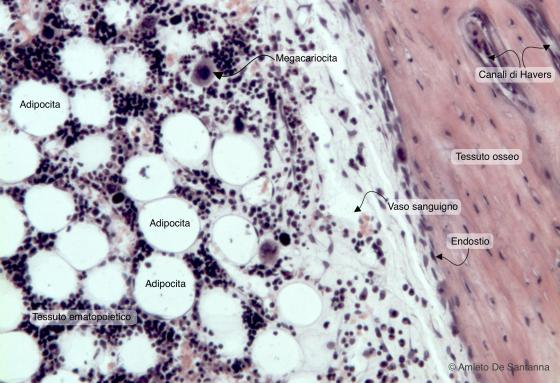
Figura C110A. Midollo osseo umano in situ a più forte ingrandimento. Si notano chiaramente sia l'endostio che riveste il tessuto osseo lamellare compatto, sia alcuni grossi megacariociti, all'interno del tessuto emopoietico. Em-Eo 100x
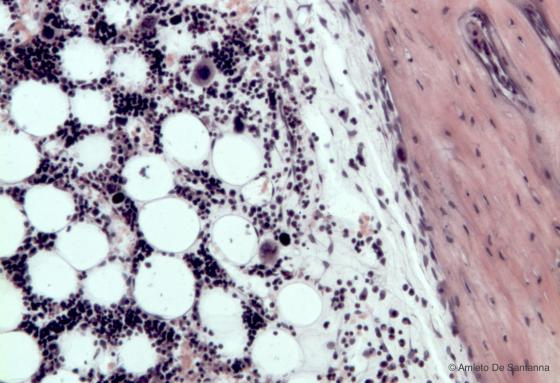
Figura C110B. Midollo osseo umano in situ a più forte ingrandimento. Si notano chiaramente sia l'endostio che riveste il tessuto osseo lamellare compatto, sia alcuni grossi megacariociti, all'interno del tessuto emopoietico. Em-Eo 100x
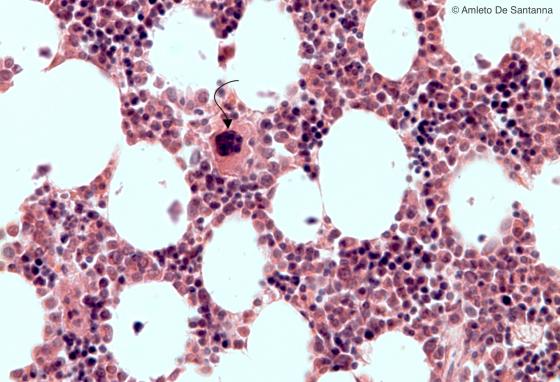
Figura C111. Midollo osseo umano a forte ingrandimento. Isole di tessuto emopoietico miste a cellule adipose. Al centro della micrografia si nota una grossa cellula con nucleo polilobato, il megacariocita (freccia), da cui originano le piastrine mediante gemmazione di porzioni di citoplasma. Em-Eo 200x
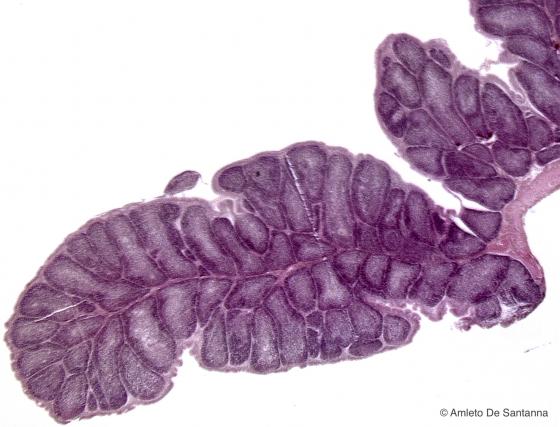
Figura C112. Borsa di Fabrizio, organo linfoide primario presente solo negli uccelli e situato nello spessore della parete intestinale. Ematossilina ferrica-Eo 12,5x
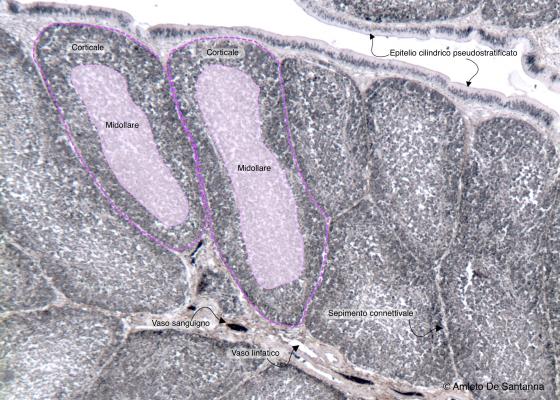
Figura C113A. Borsa di Fabrizio. Nonostante abbia un aspetto morfologico simile al timo, la borsa di Fabrizio produce linfociti B (Bursa, da cui prendono il nome). Ematossilina ferrica-Eo 63x
Figura C113B. Borsa di Fabrizio, organo linfoide primario presente solo negli uccelli. Nonostante abbia un aspetto morfologico simile al timo, la borsa di Fabrizio produce linfociti B (Bursa, da cui prendono il nome). Ematossilina ferrica-Eo 63x
Timo
Il timo è un organo situato davanti ai grossi vasi del cuore. È formato da due lobi ed è caratterizzato morfologicamente da una spessa capsula connettivale da cui si dipartono dei sepimenti che dividono l’organo in lobuli. Ogni lobulo contiene una parte periferica, detta corticale, colorata più intensamente e in cui i timociti sono più numerosi e fittamente stipati, e una parte più chiara, detta midollare, posta centralmente, dove i timociti sono meno numerosi e in cui si possono trovare formazioni denominate corpuscoli di Hassal. I corpuscoli di Hassal, o corpuscoli timici, sono formazioni rotondeggianti di circa 30-100 µm di diametro composti da cellule epiteliali midollari, altamente cheratinizzate e accartocciate concentricamente le une sulle altre. Per questo appaiono molto colorate con i coloranti basofili (nell’Em-Eo, per esempio, in rosa intenso dall’eosina).
Il timo è estremamente attivo durante l’infanzia; a partire dalla pubertà va incontro ad un processo di regressione che comporta una sostituzione dell’ordinata morfologia descritta con un’organizzazione via via più confusa, ricca di tessuto connettivo e tessuto adiposo. Nell’individuo adulto il timo si riduce a pochi frustoli di tessuto linfoide circondato da tessuto connettivo e adipociti.
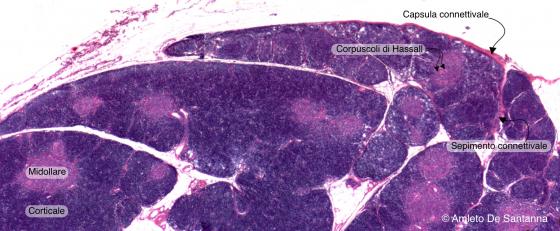
Figura C114A. Timo umano. Il timo è un organo linfoide primario popolato da cellule chiamate timociti che successivamente maturano a linfociti T. La capsula connettivale che circonda l’organo invia all’interno sepimenti che lo dividono in lobi, ognuno contenente una corticale esterna più scura e una midollare interna meno colorata. Em-Eo 10x
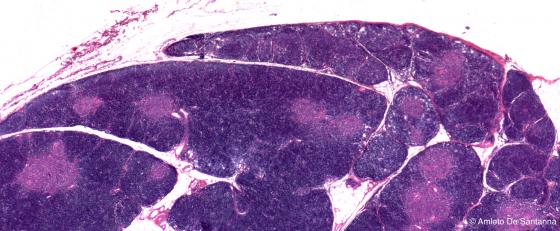
Figura C114B. Timo umano. Il timo è un organo linfoide primario popolato da cellule chiamate timociti che successivamente maturano a linfociti. La capsula connettivale manda all'interno sepimenti che dividono l'organo in lobi, ognuno contenente una corticale esterna più scura e una midollare interna meno colorata. Em-Eo 10x
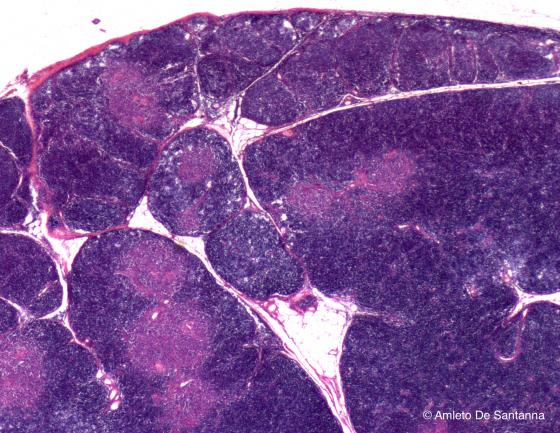
Figura C115. Timo umano a più forte ingrandimento. La capsula connettivale manda all'interno sepimenti che dividono l'organo in lobi, ognuno contenente una corticale esterna più scura e una midollare interna meno colorata. Em-Eo 40x
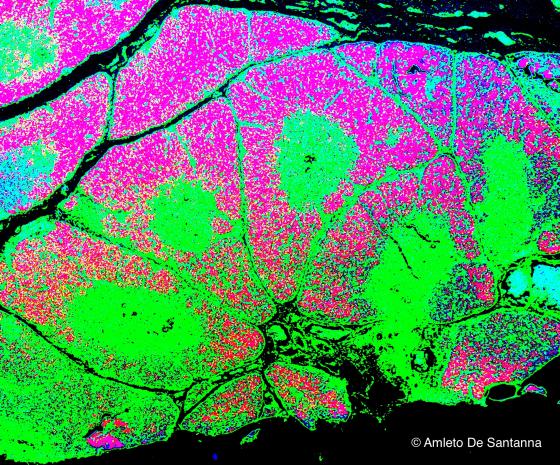
Figura C116. Timo umano a più forte ingrandimento. Micrografia elaborata digitalmente. Si notano in verde chiaro la zona midollare, in verde scuro/nero i sedimenti connettivali ed in rosa intenso la zona corticale. 40x
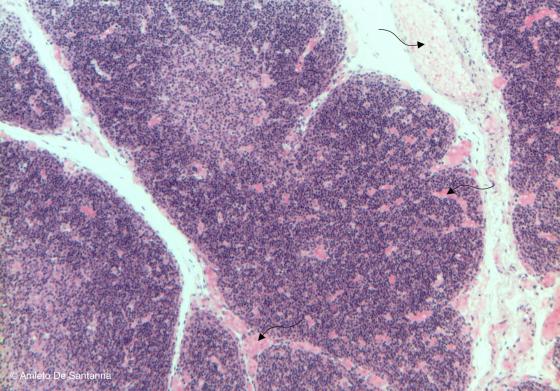
Figura C117: Timo umano. Il timo è facilmente riconoscibile come organo linfoide per la sia suddivisione in lobi, per la forte presenza di linfociti organizzati in corticale e midollare e per le formazioni eosinofile concentriche poste al centro della midollare e chiamate corpuscoli timici. Si notano numerosi vasi sanguigni colorati in rosa (frecce). Em-Eo 63x
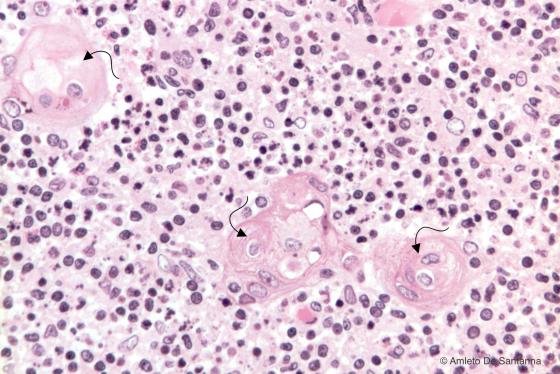
Figura C118. Timo umano. Nella midollare del timo le cellule epiteliali midollari possono assumere un andamento circolare cosi da formare bulbi detti corpuscoli timici o corpuscoli di Hassal (frecce). Queste cellule presentano evidenti segni di degenerazione. Em-Eo 200x
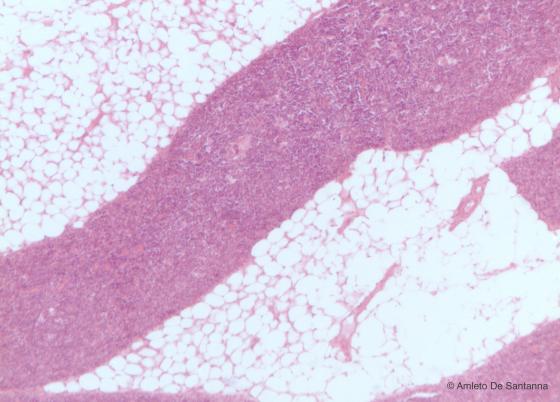
Figura C119. Timo di uomo adulto in regressione. La morfologia del timo, dopo la pubertà, si modifica progressivamente fino a che l’organo non diventa un insieme di frustoli di tessuto linfoide ricchi di adipociti e tessuto connettivo fibroso. Em-Eo 40x
Milza
La milza è un grosso organo linfoide localizzato nella cavità addominale, a sinistra, sotto al muscolo diaframma. Essa è circondata da una spessa capsula connettivale da cui si dipartono numerosi e spessi setti che, pur addentrandosi profondamente nell’organo non lo dividono in lobi, e che diventano progressivamente più sottili fino a formare una sottilissima trama reticolare che ne sostiene il parenchima. Le principali funzioni della milza sono quelle di organizzare la risposta immunitaria verso microbi che si trovano nel sangue (funzione linfopoietica, polpa bianca) e di distruggere gli eritrociti non funzionali o deteriorati (funzione emocateretica, polpa rossa).
Il parenchima della milza viene suddiviso in polpa rossa e polpa bianca con, interposta, la zona marginale, ricca di arterie e di macrofagi in attività.
La polpa bianca è caratterizzata da noduli linfatici, formazioni ovoidali composte da linfociti B, e da guaine periarteriolari composte, invece, da linfociti T. L’arteriola risulta solitamente centrale rispetto al manicotto periarteriolare. In un preparato istologico la polpa bianca è facilmente distinguibile per il colore più scuro, sia con l’Em-Eo che con le altre colorazioni convenzionali a causa dell’alta affinità dei linfociti ai coloranti acidofili.
La polpa rossa è costituita da una fitta rete di sinusoidi circondati da cellule endoteliali, macrofagi e plasmacellule, ed è distribuita uniformemente nell’organo. Al microscopio questa zona si riconosce perché più chiara, per la minor concentrazione di linfociti, e per la maggior presenza di tessuto connettivale lasso.
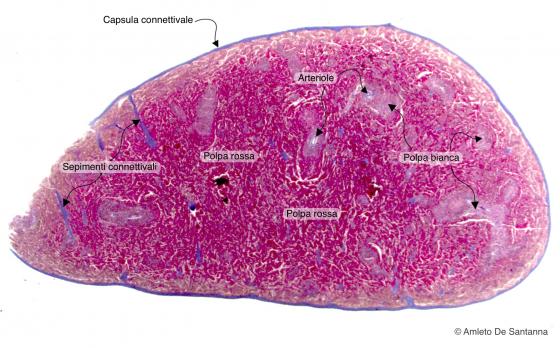
Figura C120A. Milza di topo a piccolo ingrandimento. Organo linfoide secondario. E' evidente la suddivisione del parenchima in polpa bianca e in polpa rossa. La polpa bianca è così denominata perché, nell'organo fresco, i manicotti linfocitari sono bianchi a differenza della polpa rossa che, essendo riccamente irrorata, appare rosso scuro. Azan-Mallory 12,5x
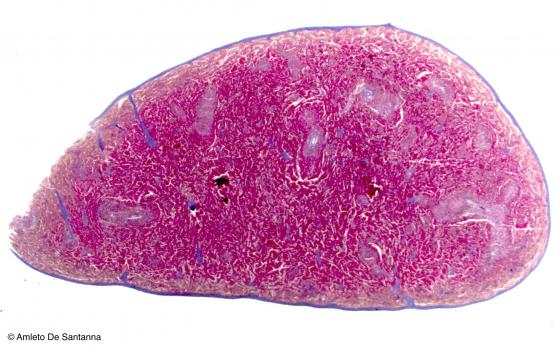
Figura C120B. Milza di topo a piccolo ingrandimento. Organo linfoide secondario. E' evidente la suddivisione del parenchima in polpa bianca e in polpa rossa. La polpa bianca è così denominata perché, nell'organo fresco, i manicotti linfocitari sono bianchi a differenza della polpa rossa che, essendo riccamente irrorata, appare rosso scuro. Azan-Mallory 12,5x
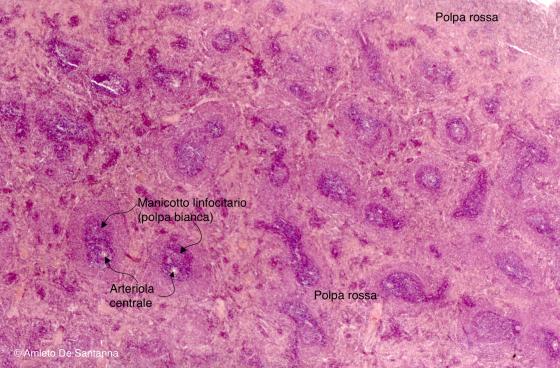
Figura C121A. Milza di topo. Organo linfoide secondario. E' evidente la suddivisione del parenchima in polpa bianca formata dai manicotti linfocitari e in polpa rossa. Em-Eo 25x
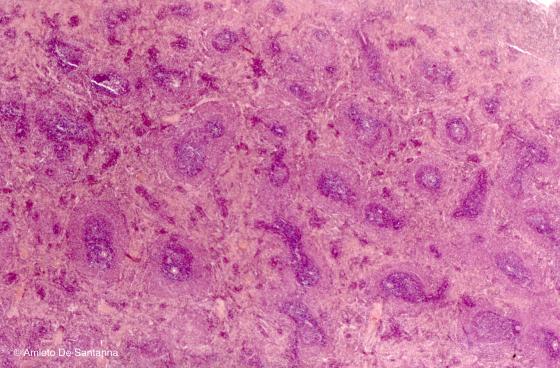
Figura C121B. Milza di topo. Organo linfoide secondario. E' evidente la suddivisione del parenchima in polpa bianca formata dai manicotti linfocitari e in polpa rossa. Em-Eo 25x

Figura C122. Milza di topo. Si nota, colorata in rosa-arancio, la capsula connettivale che manda all'interno dll'organo linfoide grossi sepimenti connettivali senza però dividere l’organo in lobi. Em-Eo 63x
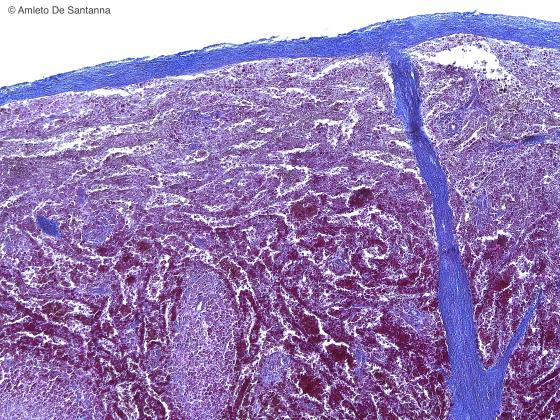
Figura C123. Milza umana. La colorazione tricromia di Azan rende evidente, colorati in azzurro, la capsula connettivale che avvolge l'organo ed i sepimenti che da questa si proiettano a supportare, insieme al connettivo reticolare, il parenchima. Azan-Mallory 40x

Figura C124A. Milza umana. Fibre reticolari argentofile che circondano un follicolo linfoide e l'arteria centrale. Bielschosky 100x

Figura C124B. Milza umana. Fibre reticolari argentofile che circondano un follicolo linfoide e l'arteria centrale. Bielschosky 100x
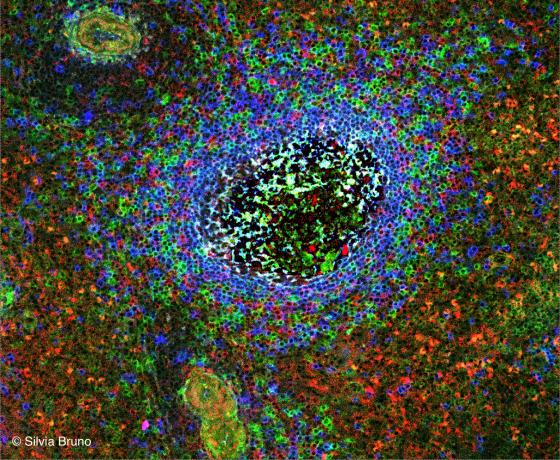
Figura C125. Milza umana. Follicolo linfoide secondario. Sono stati evidenziati i linfociti B componenti il follicolo che esprimono sulla membrana plasmatica le molecole IgG (in rosso), IgM (in blu) e IgA (in verde). Si noti la presenza di alcuni piccoli vasi. Cortesia di Silvia Bruno, Dipartimento di Medicina Sperimentale, Università di Genova.
Linfonodi
I linfonodi, in condizioni normali, sono piccoli organi ovoidali distribuiti lungo i vasi linfatici. Il linfonodo è circondato da tessuto connettivo denso capsulare che invia sepimenti che si addentrano nel parenchima linfonodale per un breve tratto e che, anche se ben evidenti, molto raramente arrivano a lambire la midollare. Il parenchima è costituito da accumuli di cellule linfatiche sostenute da uno stroma formato da una fitta rete di tessuto connettivo reticolare ed è diviso in tre zone, una zona corticale ricca di linfociti B, una zona paracorticale ricca di linfociti T, una zona midollare, ricca di plasmacellule.
La zona corticale, più periferica, è situata subito al di sotto della capsula connettivale ed è costituita da numerose formazioni ovalari dette follicoli. Quando i follicoli presentano una morfologia costante e un colore uniforme sono detti follicoli primari non attivati, quando invece, presentano una parte centrale più chiara (il centro germinativo del Fleming) circondata da una zona più scura (il mantello) vengono detti follicoli secondari attivati.
Profondamente alla zona follicolare troviamo la zona paracorticale, ricca di linfociti T stipati a formare una fitta rete in cui è molto raro trovare qualche follicolo.
Centralmente al linfonodo è situata la zona midollare, meno colorata della corticale a causa della forte presenza di vasi e tessuto connettivale. Qui i linfociti sono aggregati intorno ai cordoni midollari, ramificati e tendenti ad anastomizzarsi fra di loro. Anche nella zona midollare è presente una fitta rete di fibre reticolari che sostengono adeguatamente il lasso parenchima dell’organo linfoide. I vasi sanguiferi della midollare, in condizioni normali, sono di volume ridotto e poco visibili.
I linfociti entrano nel linfonodo attraverso due vie: per mezzo dei vasi linfatici afferenti se presenti nella linfa o per mezzo delle venule ad endotelio alto (HEV) se presenti nel sangue.
La linfa entra nel linfonodo mediante vasi linfatici (collettori prelinfonodali) che attraversano la capsula, si riversa nel seno sottocapsulare e da qui passa attraverso i seni midollari riversandosi infine nel vaso linfatico (collettore postlinfonodale) che lascia l’organo attraverso l’ilo. La linfa che raggiunge il linfonodo può anche attraversare direttamente il parenchima dell’organo per poi confluire nel collettore postlinfonodale. Questo tipo di flusso della linfa attraverso il linfonodo permette a cellule che hanno fagocitato l’antigene (ad esempio cellule dendritiche) o a microbi liberi di fermarsi nel linfonodo e permettere l’inizio di una risposta immune.
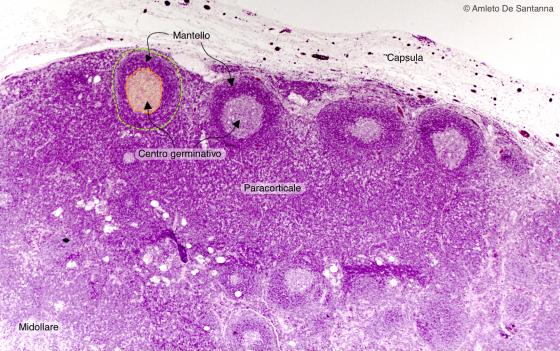
Figura C126A. Linfonodo umano. Si vedono diversi follicoli nella zona corticale di un linfonodo. Al centro del follicolo appare una zona più chiara, il centro germinativo (del Flemming), ricca di linfociti B, circondata da una zona esterna più scura, il mantello, ricca di linfociti T. Em-Eo 25x
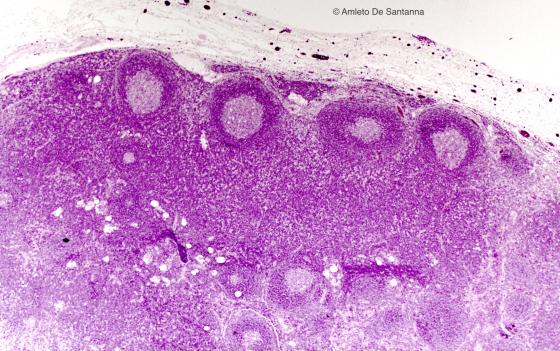
Figura C126B. Linfonodo umano. Si vedono diversi follicoli nella zona corticale di un linfonodo. Al centro del follicolo appare una zona più chiara, il centro germinativo (del Flemming), circondata da una zona esterna più scura, il mantello. Em-Eo 25x

Figura C127. Linfonodo di topo. Colorazione vitale con china che mette in evidenza, in nero, la trama vascolare dell’organo. China 63x.
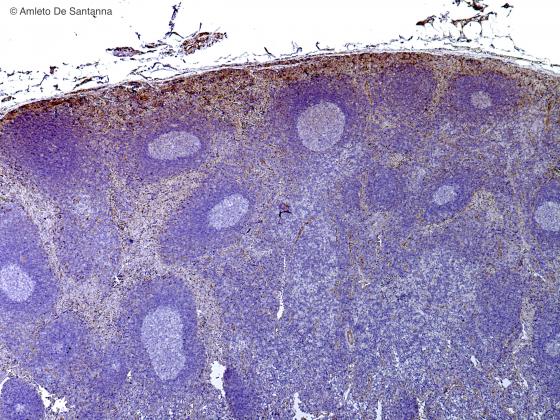
Figura C128. Linfonodo umano. Zona corticale di un linfonodo tagliato al criostato. Non si riesce ad apprezzare la midollare perché tagliato superficialmente. DAB-Ematossilina 25x
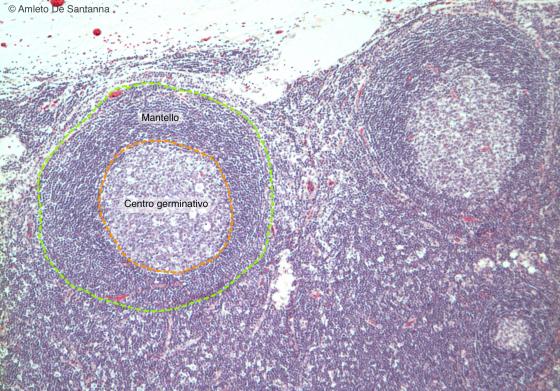
Figura C129. Linfonodo umano a più forte ingrandimento. Si vedono due follicoli nella zona corticale di un linfonodo. Al centro del follicolo appare una zona più chiara, il centro germinativo (del Flemming), circondata da una zona esterna più scura, il mantello. Em-Eo 63x
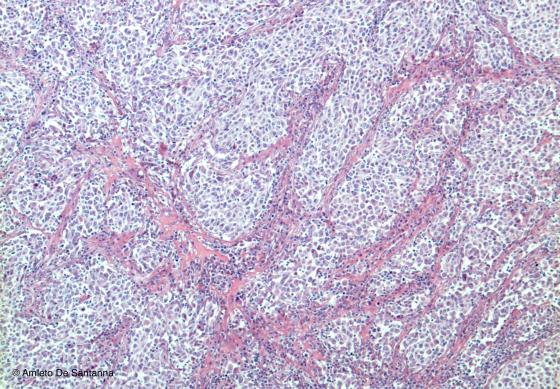
Figura C130. Linfonodo umano. La zona midollare è caratterizzata dai cordoni midollari (zone più chiare) e dai seni midollari, colorati in rosa intenso. Em-Eo 40x
Tessuto linfoide associato alle mucose (MALT)
Fanno parte del MALT formazioni quali le tonsille, le Placche di Peyer e l’appendice vermiforme. I noduli linfatici presenti in queste formazioni hanno un’organizzazione e una struttura stabile particolare e caratteristica: sono parte integrante degli organi in cui sono immersi, non hanno capsula connettivale che li delimita (ad eccezione di una emicapsula presente ad esempio nelle tonsille palatine) ma hanno una fitta trama di fibre reticolari che dà loro sostegno e la tipica forma ovale. Il tessuto linfoide associato alle mucose è organizzato in follicoli che possono essere primari o secondari a seconda che vi sia la presenza, o meno, di un centro germinativo. Microscopicamente, le tonsille si distinguono, oltre che per i numerosi follicoli che le compongono, anche per la presenza, sul margine libero, di un epitelio pavimentoso stratificato tipico del primo tratto dell’apparato digerente (nelle tonsille palatine) o di un epitelio pseudostratificato ciliato tipico dell’apparato respiratorio (nella tonsilla faringea). Profondamente all’epitelio si può distinguere una zona definita subepiteliale che si interpone tra l’epitelio e i follicoli. L’appendice vermiforme, invece, è caratterizzata da un insieme di follicoli linfatici che circondano un lume, estensione del lume intestinale, tappezzato da un epitelio cilindrico semplice e dalla presenza di ghiandole tubulari semplici.
Inoltre, tutti i tessuti connettivi, specialmente quelli lassi posti subito al di sotto degli epiteli, possono contenere ammassi linfocitari più o meno sviluppati: Questi ammassi si possono riconoscere per la presenza di piccole cellule molto colorate, i linfociti, e possono variare notevolmente in volume a seconda del grado d’infiammazione del tessuto. Gli ammassi linfoidi sono privi di follicoli, in generale non possiedono un’organizzazione spaziale specifica e sono privi di un’architettura stromale.
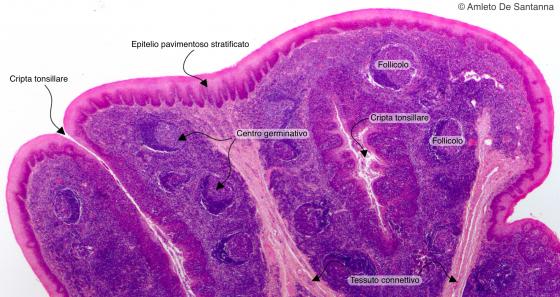
Figura C131A. Tonsilla palatina umana. Micrografia a piccolo ingrandimento di tonsilla palatina in cui si nota, sotto un epitelio pavimento stratificato, il tessuto linfoide organizzato in follicoli. La presenza di epitelio pavimento stratificato ci permettere di distinguerla dalla tonsilla faringea. Em-Eo 12,5

Figura C131B. Tonsilla palatina umana. Micrografia a piccolo ingrandimento di tonsilla palatina in cui si nota, sotto un epitelio pavimento stratificato, il tessuto linfoide organizzato in follicoli. La presenza di epitelio pavimento stratificato ci permettere di distinguerla dalla tonsilla faringea. Em-Eo 12,5
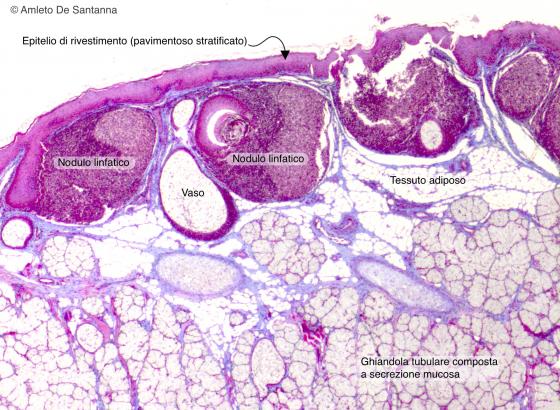
Figura C132. Tonsilla linguale umana. Tonsilla linguale in cui si nota sotto un epitelio pavimentoso stratificato il tessuto linfoide organizzato in follicoli. Azan-Mallory 25x
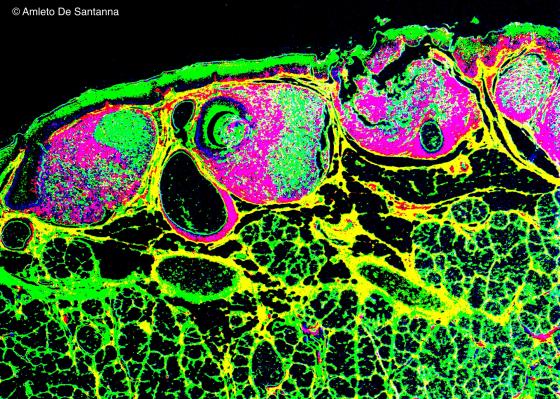
Figura C133. Tonsilla linguale umana. Micrografia elaborata digitalmente per evidenziare i noduli linfatici.25x
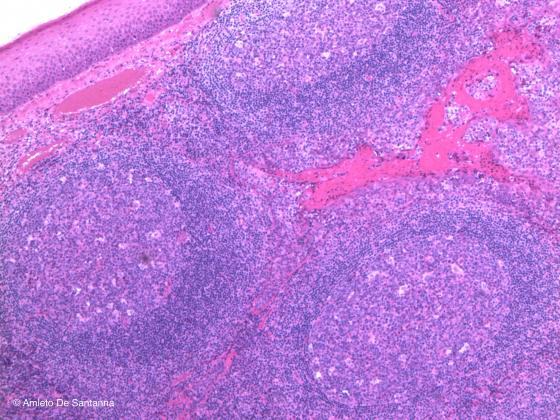
Figura C134. Tonsilla palatina umana. Al di sotto di un epitelio pavimentoso stratificato si notano tre follicoli linfoidi con al centro il centro germinativo. Em-Eo 40x
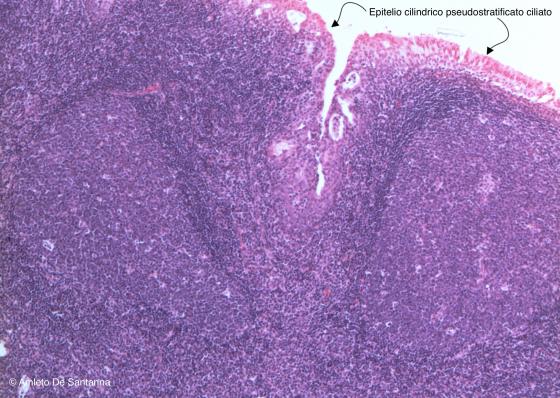
Figura C135. Tonsilla faringea umana. La tonsilla faringea si distingue dalle palatine e dalla linguale perchè presenta un epitelio pseudostratificato ciliato tipico della rinofaringe. Em-E0 40x
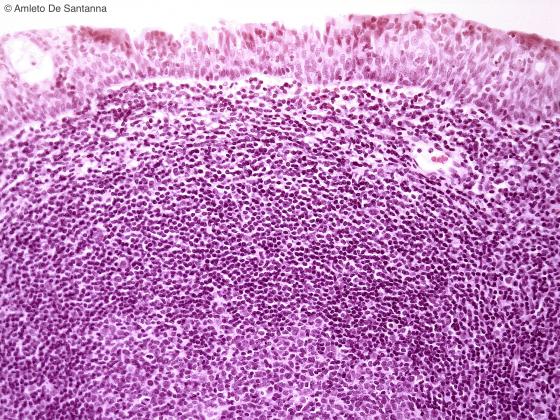
Figura C136. Tonsilla faringea umana a più forte ingrandimento in cui si evidenzia l'epitelio pseudostratificato ciliato della rinofaringe. Em-Eo 200x
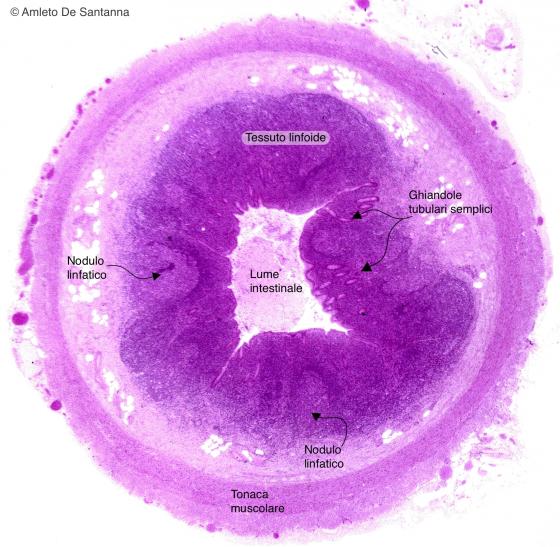
Figura C137A. Appendice vermiforme umana. Sezione trasversale. Il piccolo ingrandimento permette di apprezzare l'organizzazione dell'appendice vermiforme. Em-Eo 12,5x
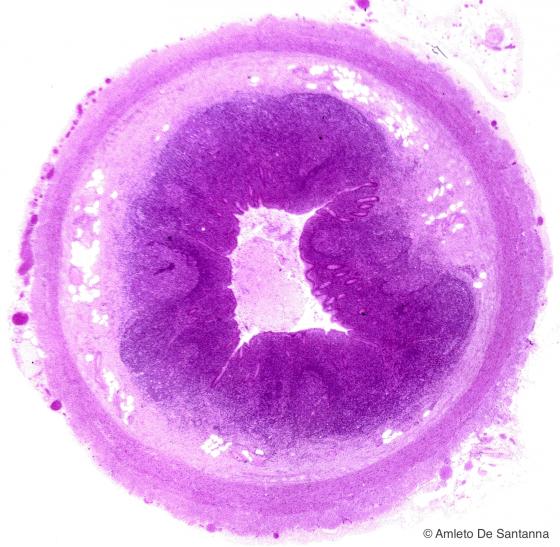
Figura C137B. Appendice vermiforme umana. Sezione trasversale. Il piccolo ingrandimento permette di apprezzare l'organizzazione dell'appendice vermiforme. Em-Eo 12,5x
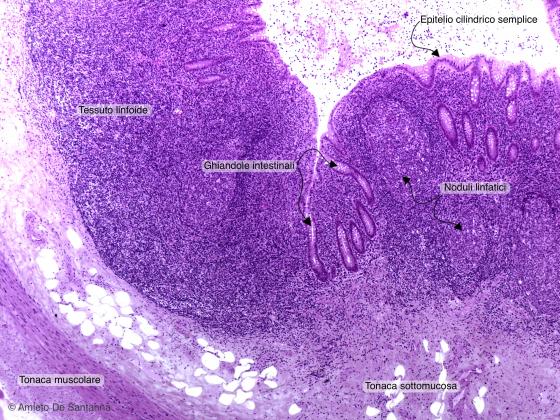
Figura C138A. Appendice vermiforme umana. Si notano le ghiandole intestinali (tubulari semplici), l'epitelio cilindrico semplice con cellule mucipare caliciformi e noduli linfatici. Em-Eo 40x
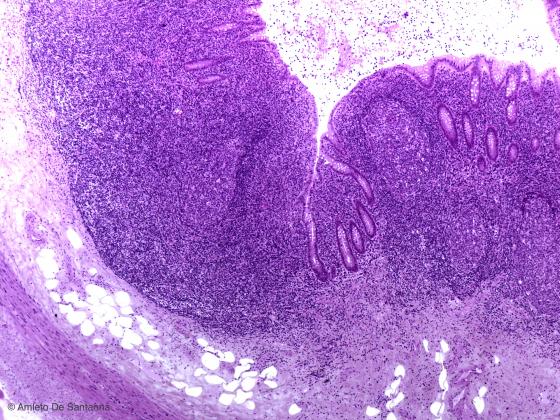
Figura C138B. Appendice vermiforme umana. Si notano le ghiandole intestinali (tubulari semplici), l'epitelio cilindrico semplice con cellule mucipare caliciformi e e noduli linfatici. Em-Eo 40x
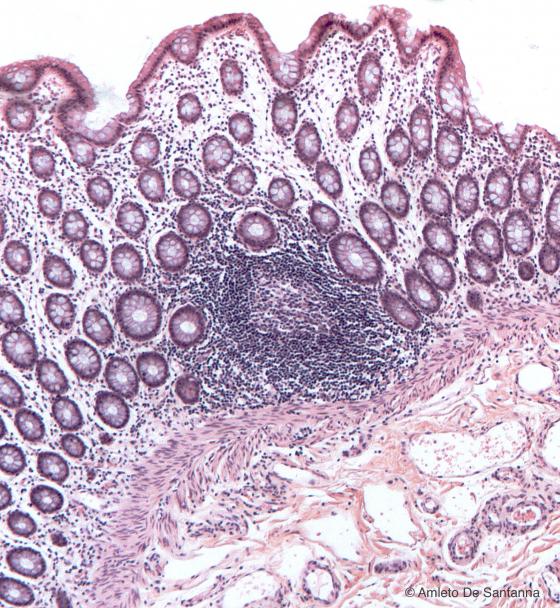
Figura C139. Colon umano. Nodulo linfatico, sezione trasversale. Em-Eo 40x
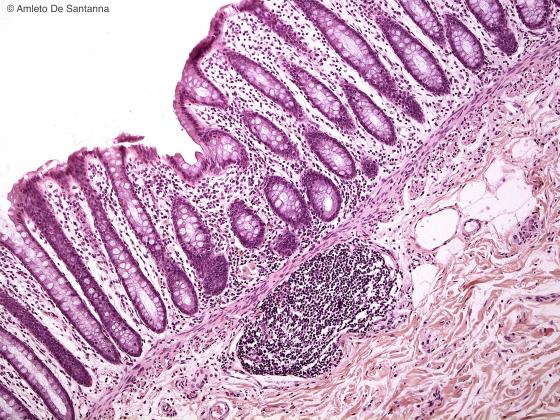
Figura C140. Colon umano. Nodulo linfatico, sezione trasversale. Em-Eo 100x
Infiltrazioni linfocitarie
In condizioni patologiche è possibile evidenziare nel contesto degli organi la presenza di infiltrati linfocitari richiamati da stimoli infiammatori.
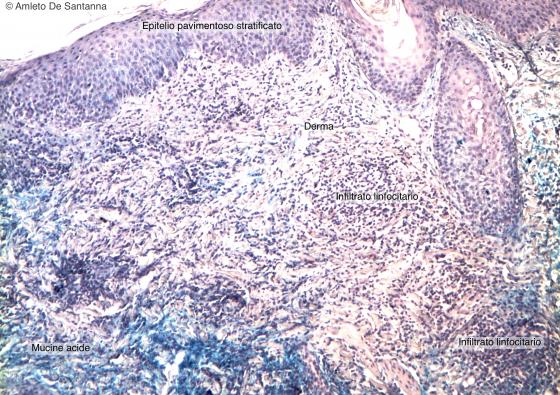
Figura C141A. Cute umana. Infiltrato linfocitario in paziente affetto da Lupus Eritematoso. Alcian Blu-Em 100x
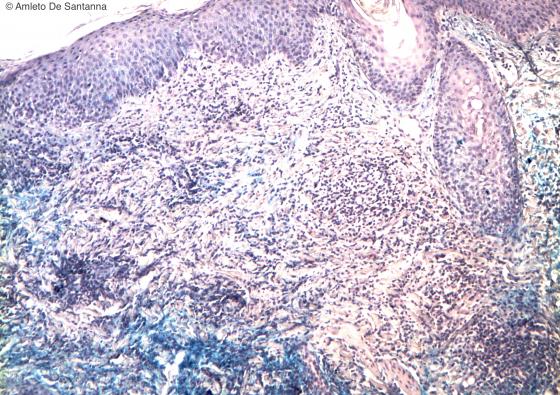
Figura C141B. Cute umana. Infiltrato linfocitario in paziente affetto da Lupus Eritematoso. Alcian Blu-Em 100x
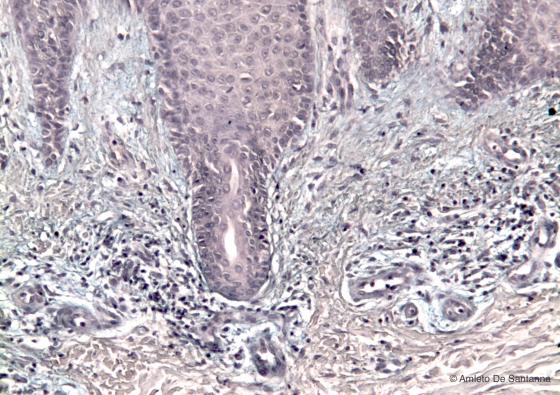
Figura C142. Cute umana. Infiltrato linfocitario nel derma sottocutaneo in paziente affetto da psoriasi. Alcian Blu-Em 100x
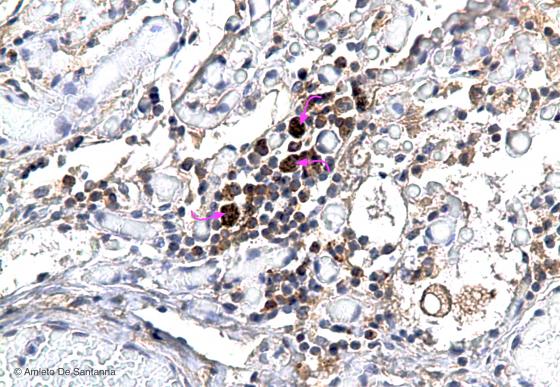
Figura C143. Polmone di delfino a forte ingrandimento. Infiltrato linfocitario e macrofagi in una infezione polmonare. Sia i linfociti che i macrofagi (frecce) sono chiaramente positivi per Bcl2 (proteina che promuove la sopravvivenza cellulare attraverso l'inibizione dell'apoptosi; precipitato marrone). DAB- Em 200x

Figura C144. Polmone di delfino. Forte infiltrato linfocitario in un bronco polmonare. Azan-Mallory 100x
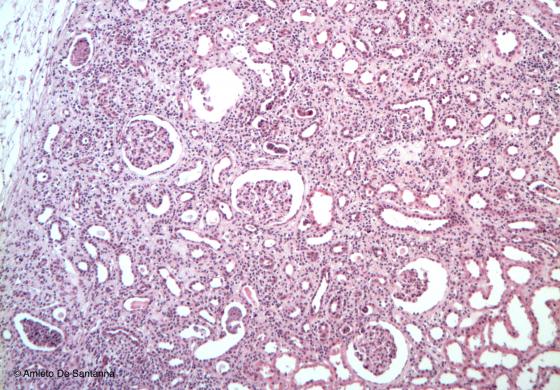
Figura C145. Rene di topo. Forte infiltrato linfocitario presente nella zona corticale ed in particolare nei glomeruli renali. Em-Eo 40x
Il sangue
Il sangue è un liquido di un caratteristico colore rosso, che circola in un sistema chiuso di canali: i vasi sanguigni. È di provenienza mesenchimale ed è formato da una parte corpuscolata (eritrociti, leucociti e piastrine) e da una liquida (il plasma). La funzione principale del sangue, oltre a mediare il trasporto di ormoni, è quella di veicolare l’ossigeno alle singole cellule che formano i tessuti. I leucociti, o globuli bianchi, si trovano comunemente, oltre che nel sangue, anche nel tessuto connettivo dove, invece di avere una forma più o meno rotondeggiante, assumono un aspetto ameboide. Solo eritrociti e piastrine svolgono i loro compiti interamente all’interno del sistema vascolare.
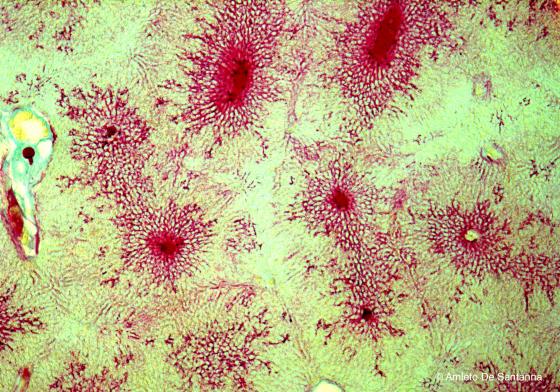
Figura C146. Fegato di topo. Iniezione vitale di colorante che mette in evidenza l'architettura vascolare del parenchima epatico. 25x
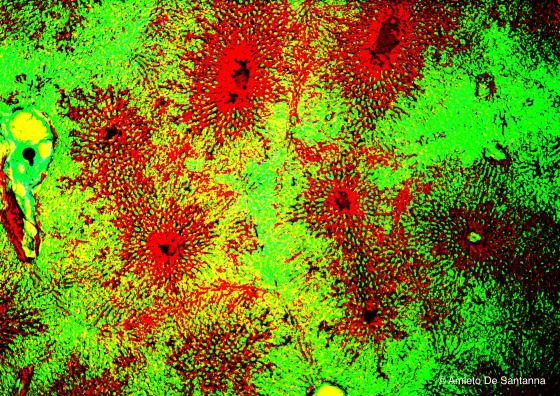
Figura C147. Fegato di topo. Immagine elaborata digitalmente. Iniezione vitale di colorante che mette in evidenza l'architettura vascolare del parenchima epatico. 25x
Eritrociti
Gli eritrociti sono piccole cellule ricche di emoglobina che conferisce loro il colore rosso. La loro principale funzione è quella di catturare l’ossigeno nei polmoni e veicolarlo ai vari tessuti. Durante il processo di maturazione, nel midollo osseo, perdono ogni proprietà DNA-dipendente e quindi il nucleo regredisce fino a scomparire. Nei pesci, nei rettili e negli uccelli il nucleo degli eritrociti è ancora presente. La ridotta dimensione dei globuli rossi permette loro di attraversare anche i capillari più periferici, mentre la caratteristica forma biconcava fa sì che queste cellule abbiano, a parità di dimensione, una maggiore superficie di scambio.
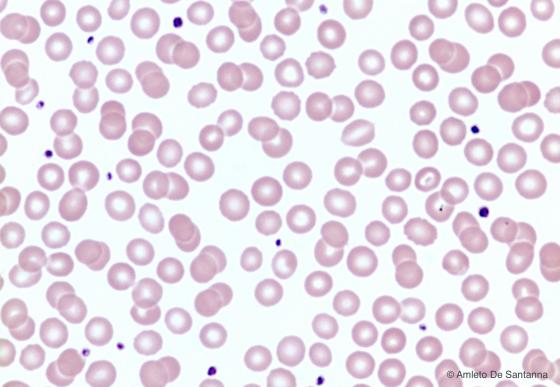
Figura C148. Striscio di sangue umano. Gli eritrociti sono colorati in rosa. La colorazione più tenue della parte centrale degli eritrociti è dovuta alla conformazione biconcava tipica di queste cellule. I frammenti di cellula più scuri sono piastrine. Em-Eo 400x
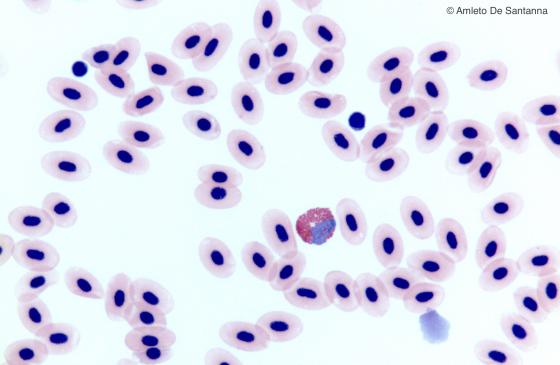
Figura C149. Striscio di sangue di rana. Si notino gli eritrociti nucleati e, al centro, un eosinofilo. Em-Eo 400x
Piastrine
Le piastrine hanno origine nel midollo osseo per gemmazione di piccole parti di citoplasma di grosse cellule chiamate megacariociti. Sono, quindi, piccoli corpuscoli di forma rotondeggiante o vagamente allungata, privi di nucleo e visibili al microscopio ottico solo a forte ingrandimento, perché di dimensioni molto più ridotte degli altri elementi figurati del sangue, eritrociti compresi. Le piastrine prendono parte al processo di coagulazione, essenziale per limitare le emorragie.
Leucociti
Sono cellule con un nucleo ben evidente. Nel sangue hanno una forma arrotondata, nel connettivo, invece, assumono un aspetto ameboide. Esistono cinque tipi di leucociti che sono classificati o in base alla presenza di granuli citoplasmatici (definiti leucociti granulari o agranulari) o alla forma dei nuclei (leucociti monomorfonucleati e leucociti polimorfonucleati).
I leucociti granulari si dividono in base alle caratteristiche tintoriali dei granuli citoplasmatici in basofili, eosinofili e neutrofili.
I leucociti agranulari si distinguono in base alle dimensioni e alla forma del nucleo in linfociti e monociti.
Neutrofili
Sono i leucociti più numerosi, circa il 50-70% del totale. Al microscopio ottico si riconoscono per la forma del nucleo che presenta tre o più lobi collegati da sottili ponti cromatinici. Sono stati anche descritti nuclei bilobati ma, per lo meno nel sangue, sono molto rari. Il numero dei lobi dipende dall’età della cellula, più la lobatura è numerosa più la cellula è vecchia, da questo si può risalire facilmente ad una maggiore o minore capacità rigenerativa del tessuto emopoietico. Nel 3% circa di questo tipo di cellule si può riconoscere una piccola protuberanza nucleare a forma di bacchetta di tamburo detta corpo di Barr (cromosoma X inattivato) indicatrice del sesso femminile del soggetto. I granuli dei neutrofili, anche se ben visibili, tendenzialmente sono molto poco colorati, da qui il loro nome. I neutrofili sono dotati di capacità fagocitaria e intervengono nella difesa dell’organismo contro le invasioni batteriche migrando attraverso le cellule endoteliali e penetrando nel connettivo dove possono espletare al meglio il loro compito. Nel corso di un’infezione batterica viene stimolata la produzione di questi leucociti che aumentano di numero.
Eosinofili
Sono facilmente riconoscibili per i loro granuli specifici colorati intensamente dall’eosina e dai coloranti acidi in generale. Il nucleo di queste cellule è sempre bilobato e con un sottile istmo a connettere i due lobi. In genere nel sangue rappresentano il 2-4% dei leucociti circolanti, ma aumentano notevolmente di numero nel corso di allergie, parassitosi, condizioni infiammatorie e malattie neoplastiche.
Basofili
Si riconoscono per la forte granulazione basofila del citoplasma che, con l’ematossilina, assume un acceso colore violetto che, di conseguenza, tende a nascondere il nucleo a forma di U o di S. Sono circa lo 0,5-1% dei leucociti circolanti. I grossi granuli basofili, contenenti eparina e istamina, sono ricchi di lisosomi che, a differenza di eosinofili e neutrofili, rilasciano il loro contenuto all’esterno e non nei vacuoli fagocitati. Intervengono sia nelle reazioni infiammatorie classiche sia nelle reazioni allergiche.
Linfociti
La maggior parte dei linfociti circolanti nel sangue si presentano sotto forma di piccole cellule rotondeggianti, molto colorate e con il nucleo che occupa gran parte della cellula, lasciando al citoplasma solo un sottile anello periferico. Queste cellule rappresentano, nel sangue, il 20-40% di tutti i leucociti circolanti. Morfologicamente i linfociti T, i linfociti B e i linfociti NK non sono distinguibili fra di loro.
Monociti
I monociti rappresentano il 3-8% dei leucociti circolanti nel sangue. Sono molto grandi e hanno un nucleo ben evidente dotato di una lobatura accentuata dall’età della cellula, così da avere un aspetto che va dal rene al ferro di cavallo. Il citoplasma è privo di granuli visibili al microscopio ottico anche se ricco di lisosomi primari. Di passaggio nel sangue, migrano nel connettivo dove diventano macrofagi o cellule dendritiche.
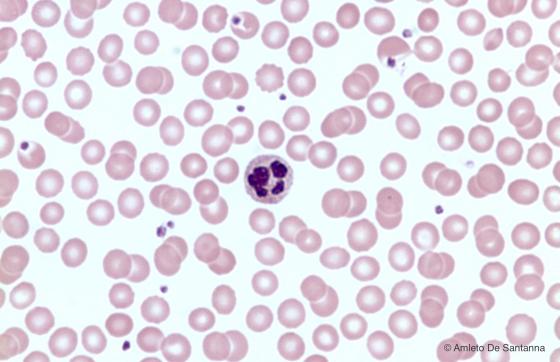
Figura C150. Striscio di sangue umano. Al centro è presente un leucocita granulare (neutrofilo) con nucleo polilobato. Em-Eo 400x
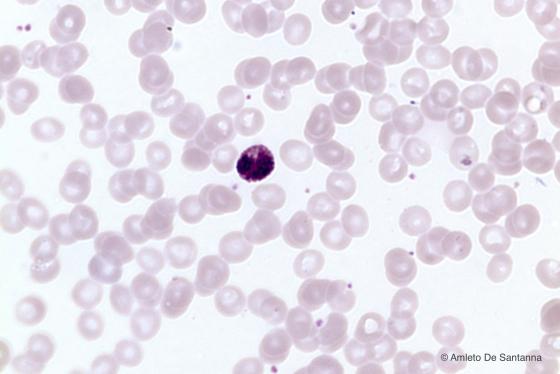
Figura C151. Striscio di sangue umano. Leucocita granulare basofilo (granulocita basofilo) riconoscibile per la grossolana granulazione citoplasmatica colorata dall'emallume (colorante basico) in viola intenso. Il nucleo è nascosto dalla granulazione basofila. Em-Eo 400x
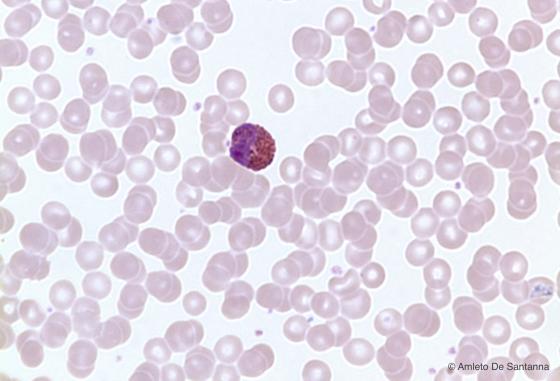
Figura C152. Striscio di sangue umano. Leucocita granulare eosinofilo (granulocita eosinofilo) con evidente granulazione rosa intensa e un nucleo generalmente bilobato. Em-Eo 400x
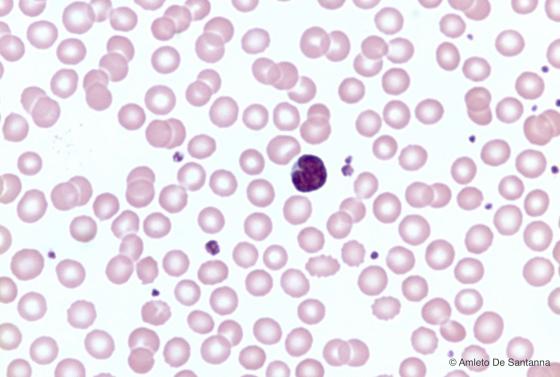
Figura C153. Striscio di sangue umano. Leucocita agranulare (monocita) con nucleo a forma di rene e il citoplasma privo di granulazione. Em-Eo 400x

Figura C154. Striscio di sangue umano. Piccolo leucocita agranulare (linfocita) con nucleo tondo molto grande, privo di lobature, che occupa circa il 90% della cellula, lasciando al citoplasma una piccolissima porzione periferica. Em-Eo 400x
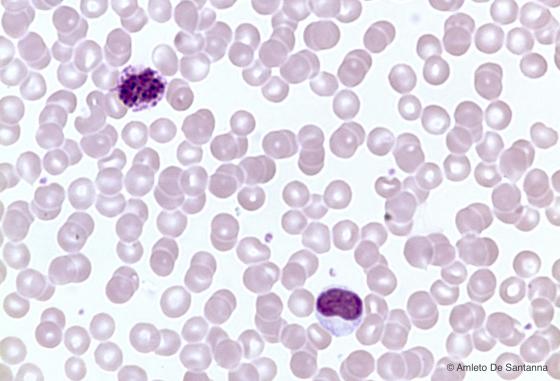
Figura C155. Striscio di sangue umano. In alto è visibile un granulocita basofilo, in basso un monocita. Em-Eo 400x
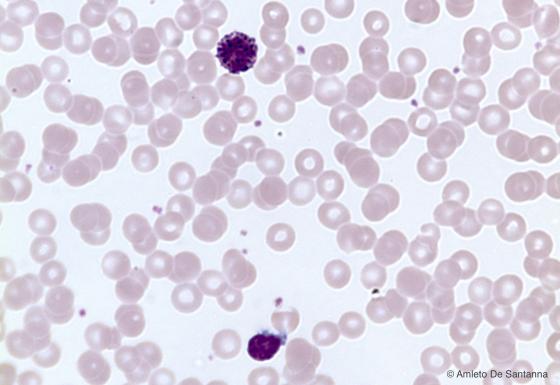
Figura C156. Striscio di sangue umano. Sono visibili in alto un granulocita basofilo e in basso un linfocita. Em-Eo 400x
